Milada Teplá
KUDCH, PřF UK v Praze
email: milada.tepla@natur.cuni.cz
Biochemie - mezioborová témata
- NA: Slovo úvodem
- NA: Studijní text
- NA: Animace
- Trávení: Slovo úvodem
- Trávení: Studijní text
- Trávení: Animace a videa
- Digestion: English version
- Dýchání: Slovo úvodem
- Dýchání: Studijní text
- Dýchání: Animace a videa
- Lipidy: Slovo úvodem
- Lipidy: Studijní text
- Lipidy: Animace a videa
- Signalizace: Slovo úvodem
- Signalizace: Studijní text
- Signalizace: Animace
- Sport: Slovo úvodem
- Sport: Studijní text
- Sport: Výukové materiály
- Volné radikály a Antioxidanty
Nukleové kyseliny, replikace, transkripce, translace a genové inženýrství
Trávicí soustava, trávení přírodních látek
Dýchací soustava, transport kyslíku a oxidu uhličitého a buněčné dýchání (dýchací řetězec a syntéza ATP)
Lipidy, biologické membrány a transport látek přes membrány
Buněčná signalizace
Biochemie a sport
Biochemie v lékařství
Schopnosti lidstva jsou obrovské, vědeckých článků o tom bylo napsáno snad miliony, ale některá fakta jsou veřejnosti málo známá, proto jsme se společně s MuDr. Václavem Holečkem, CSc. (bývalým primářem Oddělení klinické biochemie ve Fakultní nemocnici, Plzeň) ujali obtížného a nevděčného úkolu informovat o takových faktech.
Prvá kapitola se zabývá biochemickými pochody při fyzických výkonech ve sportu. Protože jednou z důležitých podmínek je rovnováha mezi oxidací a redukcí, tak logicky druhá kapitola se zabývá oxidačními volnými radikály. Třetí kapitola pak antioxidanty. Čtvrtá kapitola se zabývá poruchami této rovnováhy. Ta nastává u více než 100 nemocí a stavů. Jsou o tom veliké monografie a celé lékařské obory, takže je vyloučené to celé obsáhnout. Lze tedy jen uvést u nejvíce frekventovaných nemocí a stavů, jak se na nich podílí oxidoredukční pochody.
Oxidace a redukce v živých organismech
Volné radikály
Mezi nejvýznamnější metabolické pochody v živých organismech je
oxidace a redukce. Je všeobecně známo, že hořením vzniká energie (v
tomto případě světelná a tepelná). Hoření je oxidace, méně je však
známo, že oxidace je ztráta elektronů, redukce (antioxidace) naopak
příjem elektronů.
VOLNÉ RADIKÁLY
Volné radikály jsou látky, které mají jeden nebo více nepárových elektronů. Snaží se získat elektron do páru z okolních sloučenin (proteinů, lipidů, cukrů, nukleových kyselin aj.). Ztrátou elektronu vznikají další volné radikály, dokud nedojde k jejich terminaci. Tak např. superoxid má poločas trvání 10-6 sekundy, asi nejsilnější volný hydroxylový radikál 10-9 sekundy. Jsou i slabší volné radikály s násobně delším poločasem. Obrovská reakční rychlost zvyšuje účinnost volných radikálů.
Volné radikály jsou exogenního i endogenního původu.
Zdroji volných radikálů jsou:
- x- paprsky (po rtg ozařování vlivem x-paprsků)
- ionizující záření (expozice více než 2000 mSv najednou bývá ihned smrtící),
- UV záření,
- vznikají v reperfuzní fázi po ischemii,
- vykouřením 1 cigarety „obohatí“ se člověk o 1017 volných radikálů,
- vznikají jako důsledek mnoha nemocí (u bolesti), ale i u psychických stavů (např. po negativních emocích
- radiopaktivním zářením (např. po atomovém výbuchu, už v Hirošimě terapeuticky byly podávány antioxidanty),
- vlivem průmyslu (u škodlivin v ovzduší),
- z hnisu,
- v organismu vznikají v reperfuzní fázi po ischemii.
Přes den se volné radikály hromadí v mozku, ale během spánku jsou odstraněny, tedy spánek funguje jako antioxidant.
Při infarktu vzniká kromě volných radikálů v reperfuzní fázi i singletový kyslík, který je nebezpečný tím, že působí arytmie srdečního rytmu. Singletový kyslík je inhibován histidinem nebo polyfenolickými antioxidanty. Dekarboxylace histidinu na histamin by mohla vysvětlit některé alergické reakce. Člověk na volné radikály u infarktu myokardu reaguje tvorbou nikotinamidmononukleotidu (NMN). Volné radikály mohou poškodit i bílkovinné receptory, např. pro chuť a čich, což se často děje u infekce covidem-19.
NĚKTERÉ VOLNÉ RADIKÁLY A ROS (reactive oxygen species)
- Superoxid (O2.-) - Poločas 10-6 s. Působí lipoperoxidaci, s radikálem oxidu dusnatého (NO.) tvoří ONOO (peroxinitrit), (3x rychleji než účinkuje SOD), který nitruje proteiny (stanovují se nitrotyrosiny) = např. inaktivace akonitázy, což vede k hromadění kyseliny mléčné. Při nízkém parciálním tlaku kyslíku je produkce superoxidu respiračním řetězcem zvýšená.
- Volný hydroxylový radikál (OH.) - Poločas 10-9 s. Nejnebezpečnější volný radikál, mutace, lipoperoxidace, peroxidace proteinů. Vzhledem ke krátkému poločasu účinkuje jen v nejbližším okolí.
- Tripletový kyslík vzniká účinkem magnetického pole.
- Volný nitroxidový radikál (NO.), vzniká z L-argininu účinkem NOS, je hydrofilní, proniká membránami, s kyslíkem tvoří dusitany a dusičnany.
-
Příznivé účinky:
v nízké koncentraci relaxuje hladké svaly (vazodilatace).
ukončuje lipoperoxidaci: LOO. + NO. = LOONO
maximalizace perfuze, zvýšení zásobování kyslíkem § brání agregaci destiček a trombóze
působí antimikrobiálně, účinkuje proti apoptóze
neutralizuje VR během sepse či reperfuze
Nepříznivé účinky:
podporuje lipoperoxidaci
inhibuje sekreci insulinu po stimulaci glukózou
ve vyšší koncentraci působí genotoxicky
hraje spíše nepříznivou roli v rozvoji plicní dysfunce při ARDS
snižuje tvorbu T-buněk
cytotoxicky poškozuje játra, střevo aJ.
-
Některé ROS látky mají podobné vlastnosti jako volné radikály, ale nemají nepárový elektron (singletový kyslík, peroxid vodíku, ozón):
- Peroxid vodíku (H2O2) - proniká přes všechny membrány, v přítomnosti transitních kovů tvoří (OH.).
- Singletový kyslík ( 1O2) - poločas 10-5 s. Vzniká při fagocytóze, účinkem myeloperoxidázy, při přeměně
-
PGG2 ---> PGH2 + 1O2 ,
- při reakci dvou lipoperoxidových radikálů:
-
LOO. + LOO. ---> LOH + LO + 1O2 aj.
Mezi volnými radikály a antioxidanty je normálně rovnováha. Převaha volných radikálů nad antioxidanty se nazývá oxidační stres. Naopak převaha antioxidantů je redukční stres. Je poměr NAD+/NADH. Vyšší kvocient ukazuje na oxidační stres, nízký naopak na redukční stres. (Optimální vlnová délka pro NADH je 340 nm, pro NAD+ 260 nm).
Oxidační stres poškozuje bílkoviny, lipidy, cukry, nukleové kyseliny, redukční snižuje imunitu a signalizaci (např. mám hlad, je mi zima apod.). Poruchy redox rovnováhy patří k nejčastějším poruchám. Na životní funkce má velký vliv i psychická stránka. Negativní emoce podporují vznik volných radikálů, pozitivní naopak antioxidační schopnosti.
Oxidační stres působí pokles imunity, pokles IL-1, IL-6 a TNF-a. Vztahy jsou složité a nelze výhradně říci, že oxidační stres působí imunodepresi a antioxidační terapie naopak imunostimulaci.
Následující schema ukazuje oxidaci kyslíku a vznik volných nejčastějších volných radikálů. (SOD… superoxid dismutáza)
Fentonova reakce znamená katalytický účinek železa na oxidaci peroxidu vodíku na volný hydroxylový radikál. Železo též zvyšuje tvorbu stárnutím vzniklých senescentních buněk. Senescentní buňky nemají pro člověka význam, ale stále mu ubírají živiny, minerály a kyslík. Proti senescentním buňkám účinkují senolytika (např. fisetin, pterostilben, pycnogenol, MCOPPB aj.) Ferroptóza je typ programované buněčné smrti závislé na železe a vitaminu C. Je charakteristické akumulací lipidových peroxidů. Liší se od jiných buněčných smrtí jako je nekróza nebo apoptóza. Ferroptóza je iniciována poškozením antioxidační na glutathionu závislé obrany.
Porucha redox rovnováhy u virových infekcí se podílí na smrti buněk. RSV (Respiratory Syncytial Virus) zvyšuje lipoperoxidaci, snižuje hladinu glutathionu, aktivuje prozánětlivé cytokiny. Jestliže pomocí silných antioxidantů s nízkým redox potenciálem (např. glutathion, NMN, NAD, molekulární vodík aj.) zvládneme oxidační stres působený např. viry, zvýší se odolnost člověka proti infekci.
Volné radikály působí lipoperoxidaci, oxidaci proteinů, tvorbu AGE- látek, působí mutaci DNA aj.
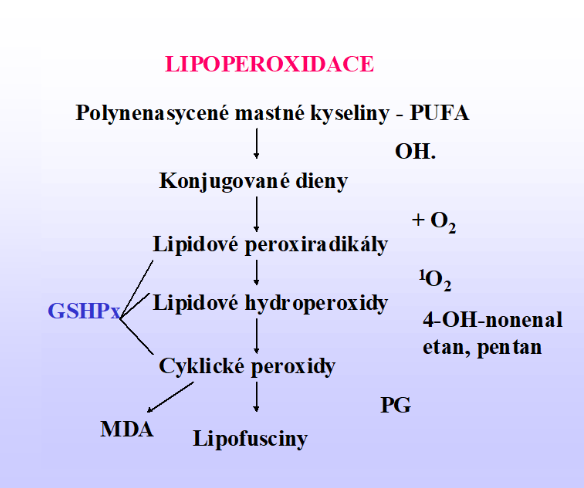
Lipoperoxidací vznikají mj. kancerogenní aldehydy malondialdehyd (MDA) a 4-hydroxynonenal. Proteiny (imunoglobuliny či spike protein vakcin) mají hodně volných amino –NH2 skupin, na které mohou vázat aldehydické skupiny H-C=O malondialdehydů peptidickou vazbou -CO-NH:
HOC-CH2-COH+ 2HN-protein → HOC-CH2-CO-NH-protein + H2O a další vazby na –COH
Malondialdehydy mohou vázat 2 a více proteinů. Vzniklé velké molekuly ztrácí svou imunitní schopnost a tak malondialdehydy chrání viry (vznikne velká molekula, která již asi nemá schopnost brzdit covid):
Malondialdehyd vazbou na acetaldehyd povrchového proteinu D (SPD) snižuje jeho vazbu na spike protein SARS-CoV-2 a tím brání neutralizaci viru. Povrchový protein D hraje důležitou roli ve vrozené imunitě proti patogenům. Malondialdehyd i další aldehydy vazbou na proteiny zvláště SPD mění strukturu a funkci plic. Protilátek proti malondialdehydu (antiMDA) je více druhů.
MDA vzniká též účinkem cyklooxygenázy na membránové lipidy a společně s acetaldehydem při oxidaci alkoholu. K inhibitorům cyklooxygenázy patří ibuprofen, kyselina acetylsalicylová, nimesulid.
MDA je reaktivní aldehyd a způsobuje toxický stres v buňkách a tvoří kovalentní proteinové adukty označované jako pokročilé lipoxidační koncové produkty (ALE), analogické k pokročilým glykačním koncovým produktům (AGE). Virus covidu-19 se před vakcínami a protilátkami, které obsahují proteiny, chrání též tím, že je naváže např. na malondialdehyd (MDA), kterého časem ubývá. (Vázaný MDA už nereaguje barevně s kyselinou thiobarbiturovou). MDA snadno reaguje s volnými aminokyselinovými funkčním i skupinami proteinů za tvorby MDA modifikovaných proteinů. Tím může docházet k ovlivnění fyziologických funkcí daného proteinu a zároveň se tento tělu neznámý protein stává imunogenním. Vazbou amino-skupiny na aldehydy malondialdehydu: –CO-NH- dvou bílkovin nebo jedné na dvou místech tvoří komplex, který snižuje potenciál inhibovat virus. Vzniklé protilátky pak komplex odstraňují z krevního oběhu.
Rozdíl v hladině MDA mezi zdravým jedincem a těžce nemocným je vysoce signifikantně nižší u nemocného (hladina významnosti: p < 0,001). Čím je vyšší hladina malondialdehydu, tím rychleji ubývá protilátek.
Snížený MDA a zvýšené TAC (celková antioxidační kapacita), IL-6 and CRP jsou dobré markery pro úmrtnost na covid.
Oxidační stres je typickým projevem RSV (Respiratory Syncytial Virus). Malondialdehyd je asi možné vyvázat hydrazinem (např. INH- isonikotinylhydrazid-lék proti tuberkulóze ) a proteiny. Snížení MDA lze docílit i snížením koncentrace lipidů (omezením biosyntézy acetyl-CoA z něhož se syntezují volné mastné kyseliny, cholesterol či ubichinol Q10, podporou aerobní glykolýzy či fenofibrátem) a omezení lipoperoxidace (antioxidanty) mohou být účinné.
Izraelští vědci prokázali úbytek virů covidu-19 snížením lipoperoxidace. Člověk snižuje hladinu MDA tím, že sám produkuje antiMDA. Epigeneticky tj. obrácenou cestou (protein→RNA→DNA) by se syntéza antiMDA mohla dostat do genetického fondu člověka a tak zvýšit obranu proti virům. Další obranou virů jsou mutace. Vakciny jsou produkovány jako protilátky proti určitému viru. Jeho změnou (mutací) se vakciny stávají méně účinnými. V DNA jsou uloženy dědičné vlastnosti, RNA je překódovaný úsek DNA a určuje sled aminokyselin v bílkovině. Oxidací dusíkatých bazí dojde ke změně nově vzniklých bílkovin, což je mutace. U RNA virů též vznikají mutace RNA-dependentní RNA-polymerázou (RdRp), která vnáší chyby do genomu viru při jeho replikaci. RdRp je kódována virovou RNA, k mutacím tedy s velkou pravděpodobností dochází u hostitele. K oxidačnímu poškození je náchylnější RNA. Bez odstranění mutací nelze eradikovat tyto nemoce. Mutacím lze zabránit malými molekulami, které se dostanou do blízkosti nukleových kyselin a jsou přednostně oxidovány volnými radikály před dusíkatými bazemi. K tomu může sloužit např. seleničitan nebo jodid draselný).
Se4+ - 2 e- → Se6+
2 I- – 2 e- = I2
Samozřejmě účinné antioxidanty mohou být dobrou alternativou terapie. K oxidačnímu poškození jsou náchylnější RNA.
Do střeva se dostávají volné radikály potravou, odbouráváním purinů, s covidem-19, v reperfuzní fázi po ischemii apod. Ve střevě vzniká mnoho imunitních látek, imunoglobulinů. Pasáží stolice střevem vlivem zpětné rezorpce klesá hladina imunitních látek, vody, iontů a antioxidantů,naopak relativně stoupá hladina volných radikálů. Ty mohou působit mutace a vznik nádorových buněk. Naředěním stolice 1:10000 ještě stačilo, aby byl detekovatelný volný hydroxyový radikál. Relativně vysoká koncentrace železa ve stolici se schopností žlučových pigmentů působit jako chelátory železa a podporovatelé Fentonovy reakce vzniku volného hydroxylového radikálu z peroxidu vodíku a superoxidu i pomocí bakterií, podporuje etiologii karcinomu kolon. Oxidace prokarcinogenů buď fekálním OH. Nebo sekundárně peroxylovými radikály (ROO.) Zřejmě proto karcinom rekta je zhoubnější než karcinom colon. Není ani vyloučeno, že mutace viru mohou vzniknout i během onemocnění člověka. Podávání antioxidantů p.os by mohlo snížit riziko karcinomů střev. Člověk ale i využívá volné radikály v leukocytech, jejich pomocí zabíjí mikrobi, bakterie, kvasinky, plísně, T-buňkami pak buňky nádorů, využívá je k signalizaci (jako mám hlad, je mi zima apod.), jimi podporuje fertilitu, imunitu apod. Spermie obsahují volné radikály a usnadňují oplodnění vajíčka. Hromadění spermií a jejich stárnutí pak ohrožuje muže mutacemi a zhoubným bujením. Volné radikály se už využívají k terapii nádorů (ozařování, některá cytostatika jako cis-platina). Byl publikován i možný nový způsob terapie injekcí viru herpesu do nádoru. Volné radikály z jím vyvolaného oxidačního stresu začaly oxidovat a štěpit biomolekuly buňky, čímž stoupl osmotický tlak, buňka nasávala vodu, aby vyrovnala osmotické tlaky, až došlo k prasknutí buňky, viry se dostaly z extracelulární tekutiny přes enzymy na povrchu membrán přes receptor ACE (angiotensin konvertující enzym 2) a transmembrání proteázu serin 2 (TMPRSS2) do dalších buněk a došlo ke zmenšení nádoru. (Vstupu do buněk brání vitamin D3, inhibitory ACE (např. kaptopril), foláty a omega-3-mastné kyseliny).
Ke sledování volných radikálů se většinou používá stanovení produktů jejich reakcí. Nejpřesnějším stanovením je elektronová paramagnetická rezonance (EPR), která využívá dvou silných magnetů a mikrovlny.
Terminace (odstranění) volných radikálů.
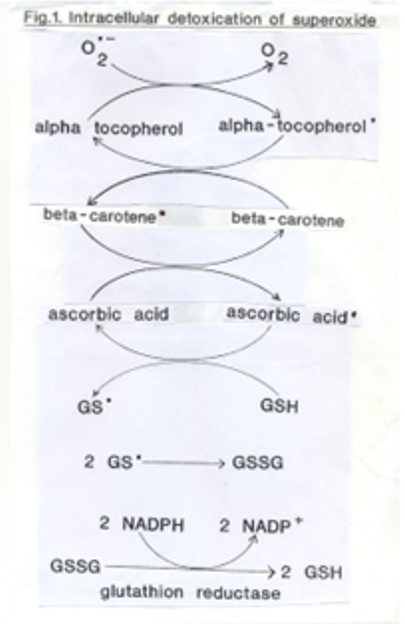
- Jednotlivé antioxidanty si předávají elektron a střídá se antioxidační funkce s prooxidační. K úplnému odstranění radikálů slouží až silné antioxidanty (glutathion GSH a NADPH).
Volný radikál →α-tokoferol → β-karoten →kys. askorbová → glutathion (GSH)→NADPH
Tedy úplné odstranění volných radikálů nastane až oba thiylové radikály (GS.) budou sdílet své nepárové elektrony (GSSG). Řetězec probíhá tak, že antioxidant s vyšším redox potenciálem (asi o 0,3 mV) oxiduje volný radikál s nižším potenciálem. - Oxidace volných radikálů přes komplex cytochomoxidázy:
Tento způsob lze urychlit podáním zředěné silné kyseliny, která dissociuje,
např. HCl = H+ + Cl-
vzniklý H+ poskytne svůj proton nejsilnějšímu hydroxylovému volnému radikálu:
(OH.- ) + H+ = H2O - Quenching (kalení asi lépe terminace) volných radikálů: Je to jakákoliv reakce, kdy z volného radikálu vznikne látka, která není volným radikálem.
- Vylučování volných radikálů stolicí, močí, potem, slinami apod. Tento způsob jejich odstraňování je dosud málo probádán.
V nohách jsou dvojí svalová vlákna: bílá – rychlostní a červená-vytrvalostní. Bílá vlákna snadněji podléhají oxidaci volnými radikály než červená. Stářím ubývají bílá vlákna- klesá rychlost, ale relativně stoupají vlákna červená –zvyšuje se vytrvalost.
BOLEST
Bolest produkuje zvýšené množství volných radikálů. Ty mj. působí zvyšování hladiny AGE (advanced glycation end-products). Vznik AGE látek je rychlejší než jejich odbourávání, které probíhá po vazbě na receptor (RAGE). Hladina AGE stoupá v těle s věkem. AGE látky pak podporují tvorbu dalších volných radikálů. Naopak hladina antioxidantů s věkem klesá. Glykované bílkoviny, AGE (advanced glycation endproducts) aktivují receptory (RAGE) a působí dlouhotrvající zánět, provázený tvorbou dalších volných radikálů. RAGE aktivují tvorbu NF kappaB a aktivuje se intracelulární oxidační stress a potlačují se některé endogenní autoregulační funkce. AGE látky vznikají vazbou glukózy obvykle na lysinové zbytky. Dochází k celé řadě dalších reakcí (Amadoriho a Schiffovy baze, Maillardovy produkty), kdy AGE látky zvyšují vaskulární permeabilitu, inhibují vaskulární dilatací tím, že blokují oxid dusnatý, oxidují LDL-cholesterol, podporují produkci různých cytokinů a zvyšují oxidační stres. Dále urychlují oxidační poškození tkání a buněk a podporují koagulopatii. Sérové koncentrace AGE byly signifikantně vyšší u nediabetických pacientů s onemocněním koronárních arterií a signifikantně korelovaly s počtem stenosovaných cév. Je tedy vztah mezi AGE a závažností koronárního onemocnění nediabetických pacientů a podle hladiny sérových AGE se může předvídat vaskulární poškození. Pacienti s fibromyalgií mají vyšší hladiny AGE (pentosidinu) v séru než kontroly. AGE modifikace snižuje rozpustnost a má vysokou rezistenci na proteolytické trávení. AGE stimulují buňky aktivací NF kappaB pomocí receptorů RAGE. To přispívá ke vzniku, trvání a šíření bolesti u pacientů s fibromyalgií. Stanovení AGE látek před a po terapii akutní a chronické bolesti by mohlo umožnit posoudit intenzitu bolesti a kvalitu terapie.
Sterilizace vody účinkem volných radikálů:
Ozařování UV slunečními paprsky (volné radikály) trubice s vodou po dobu asi 6-8 hodin sterilizuje vodu. Trubice nesmí být skleněná (sklo nepropouští UV paprsky), nedoporučuje se ani polystyrén. Případně vodu lze před ozářením přefiltrovat přes nanovláknový filtr. Takto upravenou vodu údajně lze použít jako pitnou v místech s jejím nedostatkem.
Antioxidanty
ANTIOXIDANTY
Antioxidanty jsou dárci elektronů, látky, jejíchž molekuly omezují aktivitu kyslíkových radikálů – snižují pravděpodobnost jejich vzniku nebo je převádějí do méně reaktivních nebo nereaktivních stavů.
Antioxidanty jsou tedy různé, ne každý antioxidant odstraňuje kterýkoliv volný radikál.
- Kvantita antioxidantů se vyjadřuje celkovou antioxidační kapacitou.
- Kvalitu antioxidantu vyjadřuje tzv. redox potenciál, což je vyjádření míry schopnosti redoxního systému převést jednoho z reakčních partnerů do oxidovaného stavu. (Pozn. pro vodík platí: H+/H2 redox potenciál =0,000 mV.)
Vliv volných radikálů a antioxidantů na acidobazickou rovnováhu nebyl dosud důkladně probádán. Acidóza má antioxidační vlastnosti, naopak alkalóza působí synergicky s volnými radikály. Proti oxidačnímu stresu účinkují především antioxidanty s nízkým redox potenciálem, jejichž antioxidační schopnost je vysoká a prooxidační malá.
Antioxidanty hlavně vznikají jako obrana před volnými radikály. Je to i ochrana před ohrožením života (hladem, zářením, jedy, stresory atd.), nazývá se hormeze. Pokud k ohrožení člověka nebo rostlin nedochází, hormeze se stává méně účinnou. Tyto stresy vedou k tvorbě látek v těle, ale i v rostlinách, které často působí i proti stárnutí (např. sirtuiny) a jejichž antioxidační účinek nemusí být hlavním důvodem jejich aplikace.
Antioxidantů je mnoho druhů. Lze je zařadit do více skupin:
1) ENDOGENNÍ ANTIOXIDANTY
Enzymatické
- Mitochondriální cytochromoxidázový systém
- Superoxiddismutáza (SOD)
- Kataláza
- Glutathionperoxidáza (GSHPx, GPx)
Neenzymatické
- Membránové (lipidová fáze): Alfa-tokoferol, Beta-karoten
- Nemembránové (vodní fáze): Kyselina askorbová, uráty, cystein, albumin, ceruloplasmin,
transferin
Intracelulární
- Glutathion, thioredoxin reduktáza
Extracelulární
- Kyselina močová, albumin, proteiny, bilirubin, vitamin C, E aj.
2) EXOGENNÍ ANTIOXIDANT
Inhibice xantinoxidázy: Allopurinol, kyselina listová, pterinaldehyd, wolfram
Zábrana přeměny xantindehydrogenázy na xantinoxidázu: Trypsinový inhibitor ze sojových bobů
Detoxikace H2O2: Kataláza, PEG-kataláza aj.
Inhibitory NADPH oxidázy: Adenosin, lokální anestetika, blokátoři kalciových kanálků, monoklonální protilátka proti NADPH oxidáze aj.
Prodloužení poločasu SOD: SOD s velikou molekulovou hmotností (genové inž.), PEG-SOD, stabilní cyklické nitroxidy odvozené od oxazolidinu aj.
Neenzymaticke scavengery volných radikálů: Manitol, albumin, DMSO, DMTU, lazaroidy, cimetidin, stobandin
Redox inhibitory, cheláty: Desferoxamin, ceruloplasmin
Zvyšování aktivity glutathionperoxidázy: Ebselen, glutathion, N-acetylcystein
Inhibitory adheze neutrofilů: Monoklonální protilátky proti komplexu CD 11/CD 18 aj.
Anorganické látky s určitou antioxidační schopností: Selen, zinek, magnesium, chrom, mangan
Proteiny poskytují volným radikálům elektron a tedy mají též antioxidační schopnost. V těle mají různě dlouhý poločas trvání, pak jsou obnovovány. Syntéza bílkovin probíhá cestou DNA→RNA→bílkovina, ale může probíhat i opačným směrem, čímž se návod na syntézu mutované RNA může dostat do genetického fondu DNA člověka (epigeneze). Proteiny jako antioxidanty zachytí 50 % – 75 % všech tvořených ROS/RNS. Následky oxidačního pozměnění proteinů jsou nevratné a negativně ovlivňují fyziologické funkce proteinů. Může docházet k poruchám jejich enzymatických, strukturních a vazných vlastností, k ovlivnění exprese proteinů a jejich metabolismu, dysregulaci buněčné signalizace a indukci apoptózy či nekrózy. Hromadění poškozených nedegradovatelných proteinů může vést k úplné inhibici proteazomů, což je intracelulární proteinový komplex s proteolytickou aktivitou, který slouží k likvidaci přebytečných, afunkčních a defektních proteinů. Nakonec dochází k metabolickému rozvratu uvnitř buňky a spuštění apoptotických či nekrotických mechanizmů.
Ve spánku a tmě jsou z mozku odstraňovány přes den nahromaděné volné radikály, takže i spánek lze považovat za antioxidant.
Člověk si umí antioxidanty vyrábět ve svém těle (kyselinu močovou, bilirubin aj,). Novorozenec mívá vyšší bilirubin po narození, protože ještě jeho tělo nemá vyvinutou antioxidační ochranu proti kyslíku. Rovněž hodně spí, proto má i vysoký melatonin. Většinu antioxidantů získává člověk v potravinách a nápojích.
Antioxidanty chrání buňky před volnými radikály, ale chrání i buňky nádorové! Rakovinotvorným buňkám se daří v kyselém prostředí, zatímco v zásaditém umírají do 3 hodin. U nádorů je tedy třeba opatrnosti při podávání antioxidantů.
Stárnutím po 60. roce klesá celková antioxidační kapacita organismu, což může být příčinou, proč senioři jsou více ohroženi infekcí, a dalšími nemocemi jako obesitou, nádory, záněty, neurodegenerativními chorobami aj.
Rostliny vystavené UV záření na svou obranu produkují antioxidanty, které se tak dostávají do býložravců a lidského organismu. Nové antioxidanty jsou hledány v tropických pralesích, v poslední době i v mořích. Při velkém nadbytku antioxidantů nastane porucha signalizace.
**************************************************************************************************************
Významnými antioxidanty jsou mj.:
- Pyridinové koenzymy (NMNH, NADH - nikotinamidadenindinucleotid, NADPH). Mají význam v kardiologii a mnoha dalších oborech. Biosyntéza pyridinových koenzymů vychází z kyseliny nikotinové a nikotinamidu. Jinou cestou syntézy NAD+ je z tryptofánu přes kynurenin, vedlejší cestou pak vzniká i serotonin a melatonin. Farmaceutický průmysl vyrábí řadu preparátů s NMN, který je prekurzorem NAD+ a snižuje edém a poškození mozku i velikost hematomu, oxidační stres a zánět. NMN brání před poklesem NAD+ a chrání před metabolickým syndromem a intolerancí glukózy. Pokles NAD+ v mitochondriích se považuje za příčinu stárnutí a ztráty paměti. Podání NAD+ chrání před poruchami mozku jako je amyotrofická laterální skleróza nebo iktus. U nízké hladiny NAD+ dochází k poruše komunikace mezi mozkem a mitochondriemi. V 80 letech mívají lidé jen 1-10% hladiny oproti mládí. NAD+ stoupá po resveratrolu, cvičení a nízkém kalorickém příjmu. Kdybychom neměli NAD+ v těle zemřeli bychom do 30 sekund.
- Niacin je prekurzorem, NADPH, který je důležitým energetickým zdrojem mj. pro redukci GSSG na GSH, což je klíčová reakce regenerace mnohých antioxidantů. Niacin zvyšuje hladinu apolipoproteinu AI a snižuje apo B, C a E, což má význam při léčení aterosklerózy.
- Melatonin snižuje absorpci cholesterolu, zvláště jeho LDL frakci, snižuje i hladiny triacylglycerolů, hladinu HDL zvyšuje. Podává se i per os v dávkách 10 – 80 mg/den, reguluje průtok krve mozkem. Melatonin chrání před ionizujícím zářením 500x více než známý radioprotektor dimetylsulfoxid. Alzheimerovy choroby noční vzestup melatoninu obvykle chybí.
- CeO2 chrání před oxidací, používá se v terapii makulární degenerace.
- Molekulární vodík je velmi silné antioxidační a protizánětlivé agens a zvyšuje duševní bdělost a dodává tělu energii. Vyrábí se jako plyn, vodný roztok či v tabletách. Má příznivý účinek na Alzheimerovu a Parkinsonovu chorobu, neonatální poruchy mozku (např. na ischemii retiny a traumatická poškození mozku).
- Ergothionein je aminokyselina, s věkem se jeho hladina snižuje. Proteinový přenašeč přesouvá ergothionein do buněk, zejména těch, které se potýkají s vysokou úrovní oxidačního stresu, jako jsou červené krvinky a buňky v centrálním nervovém systému. Ergothionein je neuroprotektivní (Parkinsonova a Alzheimerova choroba), chrání před β-amyloidem, oxidačním stresem, snižuje zánět. Ergothionein může podporovat kognitivní funkce, aktivně vyhledává a neutralizuje širokou škálu volných radikálů a tak pomáhá chránit před oxidačním stresem. Byl také nalezen ve vysokých hladinách v kožních buňkách a může snížit hladiny volných radikálů v kožních buňkách způsobených vystavením ultrafialovému záření ze slunce a zpomaluje jejich stárnutí. Je i v mateřském mléce a prochází placentou. Zdá se, že ergothionein má také potenciál chránit náš kardiovaskulární systém a mozek před účinky stárnutí.
- Glutathion je intracelulární antioxidant, syntezováný v játrech. Vstřebává se líp než směs kys. glutamové, cysteinu a glycinu.
Za den je z jater uvolněno do cirkulace cca 14 g redukovaného glutathionu (GSH). U nových hospitalizovaných pacientů s chronickým onemocněním je v krvinkách nedostatek redukovaného glutathionu. Naopak u lidí s výbornou fyzickou kondicí a dobrým duševním zdravím je hladina vysoká. Jeho tvorbu může zvýšit nedostatkový cystein (kupř. ACC).
GSSG je z buněk odstraňován vazbou na protein. GSH zpětně redukuje antioxidanty, detoxikuje hydroperoxidy, chrání HS-skupiny, snižuje cytotoxicitu adriamycinu, příznivě ovlivňuje intoxikaci alkoholem, po úraze hlavy chrání mozkové buňky. Má vztah i k hyperhomocysteinemii. Snížené hodnoty jsou u srdečních nemocí, u diabetu, stárnutím, využívá se jako hepatoprotektivum. - Thioredoxin reduktáza Důležitý intracelulární antioxidant, selenoenzym. Má význam pro syntézu DNA, fertilizaci, účinkuje proti oxidačnímu stresu v CNS. Chrání před vznikem nádorového bujení, ale už vzniklý nádor může naopak chránit před volnými radikály. Intracelulární antioxidanty jsou zvláště důležité, protože v buňce se tvoří množství volných radikálů. Inhibice thioredoxin reduktázy může být použita u chronických zánětů (např. u revmatoidní artritidy).
- Ginkgo biloba: Extrakt z listů stromu jinanu dvojlaločného. Obsahuje flavonové glykosidy, ginkgolidy, Působí jako scavenger superoxidu a (OH.). V plasmě vrcholí za 1,5 – 3 hod., částečně inhibuje IMAO, zvyšuje odolnost proti nízké hladině kyslíku, zlepšuje prokrvení mozku (snižuje viskozitu krve), snižuje únavu, zlepšuje sexuální funkce. Chrání před lipoperoxidací, brzdí syntézu tromboxanu.
- Pycnogenol z Pinus maritima, extrakt z kůry borovic. Obsahuje 40 aktivních složek, hlavně proanthocyanidiny, ale i polyfenoly a org. kyseliny (kávová, fumarová, skořicová, ferulová aj.).
Rychlost absorpce: 15-20 min. Vlastnosti: zlepšuje rezorpci vit. C a E, snižuje toxicitu glutamátu v mozkových buňkách. Dávkování: 1,0-3,0 mg/kg, udržovací dávka 50-60 mg/den.
Terapeutická aplikace: alergie (snižuje tvorbu a uvolňování histaminu),
DM, ateroskleróza (snižuje oxidaci LDL-cholesterolu), záněty, Alzheimerova a Parkinsonova choroba, chronický únavový syndrom, stres. - Koenzym Q10 (Ubichinol)
skládá se z 10 izoprenidů, vyskytuje se ve všech buňkách (v lidském těle jsou ho cca 2 g). Denní příjem: nejméně 10 mg.Terapeutická dávka: 100-300 mg. Blokádou syntézy cholesterolu (statiny) se blokuje i biosyntéza ubichinolu Q10. Vlastnosti: chrání před lipoperoxidací, podílí se na regeneraci vitaminů C a E, zvyšuje výkonnost srdce, snižuje počet záchvatů anginy pectoris. Pokles CoQ10 o 25 % ve tkáni může už způsobit příznaky onemocnění. Stárnutím hladina KoQ10 klesá (nejdříve v srdci). Nedostatek CoQ10 oslabuje imunitní systém, klesá tvorba T-lymfocytů.
CoQ10 má 3 funkce v mitochondriích: přenos redukčních ekvivalentů na elektronový transportní řetězec, tvorba superoxidu a vychytávání volných radikálů. Ubichinol v buňkách regeneruje thioredoxin reduktáza,. U náročného tréninku sportovců je jakoby odssáván rychle z krve koenzym Q-10, takže se nelze spoléhat na to, že se nahradí jen z potravy. Z lidí starších 90 let byli výrazně mentálně schopnější ti, kteří měli v krvi vyšší hladinu koenzymu Q-10, který chrání mozkové buňky. - Vitamin C je ve vodě rozpustný antioxidant, může účinkovat i prooxidačně. Fe3+ redukuje na Fe2+ a tak podporuje Fentonovu reakci. Vitamin C redukuje lipidové peroxyradikály na hydroperoxidy, snižuje tvorbu 1O2. Ztráta schopnosti tvořit vitamin C u člověka asi vedla k produkci lipoproteinu a (Lp a) a ke ztrátě schopnosti oxidovat kyselinu močovou. Podporuje syntézu kolagenu, snížená hladina vitaminu
C je u kuřáků, u nádorů (zvláště mozku), u DM aj. - Vitamin E (tokoferol) je absorbován s chylomikrony. Vyskytuje se v 8 izomérech. Tokoferoly a tokotrienoly mají příznivý vliv též tím, že jsou z jater žlučí vraceny zpět do gastrointestinálního traktu. Vitamin E účinkuje v buněčných membránách, které chrání před propagací volně radikálových reakcí. Nedostatek vitaminu E působí neurologické dysfunkce, myopatie, zkrácení životnosti erytrocytů aj. Alfa- tokoferol samotný nebo s kyselinou askorbovou chrání gastrointestinální trakt před oxidačním poškozením účinkem železa.
- Flavonoidy jsou scavengery peroxylových a hydroxylových volných radikálů, chrání před lipoperoxidací, inhibují lipoxygenázu a cyklooxygenázu, chelátory kovových iontů. Je jich více než 5000, většinou jsou rostlinného původu.
- Kyselina močová je nejvýznamnější extracelulární antioxidant v séru. Při její biosyntéze vznikají 2 superoxidy na úrovni xanthinoxidázy. Kyselina močová váže Fe a Cu, snižuje singletový kyslík a (OH.).
- Ceruloplasmin pomáhá oxidovat Fe2+, váže Cu.
- Apigenin je antioxidační a protizánětlivá sloučenina, která se přirozeně vyskytuje v rostlinách. Nachází se v ovoci a zelenině, například v petrželi, cibuli, pomerančích, heřmánku, pšeničných klíčcích a některých kořeních. Uvažuje se o protinádorovém účinku (prostata?).
- Resveratrol je antioxidantem z červeného vína. Zlepšuje náladu, pomáhá proti rezistenci na insulin.
- NRF2 ( NRF2 je nuclear erythroid 2-related factor), regulátor resistence na oxidanty). Má centrální roli v obranných mechanismech proti oxidačním a elektrofilním poškozením. Je to transkripční faktor, který představuje ochranu buněk před oxidačním, proteotoxickým a metabolickým stresem. Hraje klíčovou roli v ochraně organismu proti stresům, ale zvýšená hodnota může hrozit vznikem karcinomů.
- MnSOD (Mn superoxiddismutáza) je antioxidant produkující peroxid vodíku. Jeví se jako perspektivní protinádorový lék.
- Sirtuiny je jich 7 NAD+ závislých enzym-deacetyláz histonů (SIRT1 – SIRT7) i dalších látek, regulující metabolismus a i antioxidační vlastnosti, proto jejich vliv na vznik karcinomu se může lišit. Jejich produkce je stimulována ohrožením života, stresem a kalorickou redukcí a intensivním cvičením. Na zvířatech bylo prokázáno, že prodlužují délku života. Inhibitory histon deacetyláz - sirtuinů (apicidin, trichostatin-a, panobinostat a entinostat) mají neuroprotektivní a neurodegenerativní vlastnosti a zlepšují některé příznaky Alzheimerovy choroby.
- Endorfiny snižují pocit bolesti, tvoří se v centrálním nervovém systému a v hypofýze. Působí dobrou náladu, vznikají jako odpověď na stres, bolest, ale i po jídle, cvičení či sexu. Lze je zařadit mezi antioxidanty
- Karotenoidy jsou antioxidanty. Je jich více druhů. Existuje i nepřímá úměra mezi příjmem beta -karotenu a rizikem degenerativních onemocnění. Beta-karoten působí jako antioxidant nejlépe při nízkém tlaku kyslíku. To je fyziologický stav v mnoha tkáních. Naopak při vysokém parciálním tlaku kyslíku působí beta-karoten prooxidačně. Zmražení vyvolá pokles karotenoidů. Limitující v lymfatické absorpci vitaminu A je enterocyt a tvorba chylomikronů. Lykopen je červený, podobně jako ostatní karotenoidy, je rozpustný v tucích a chrání je před oxidací. V lidském séru a tkáních je lykopen hlavně jako cis-izomer, zatímco v produktech z rajčat je hlavně jako all-trans-lykopen. Ten je méně biodostupný. Více se vstřebává lykopen z teplem upravených produktů z rajčat jako z kečupu, omáčky, pasty než z čerstvých rajčat. Z odstředěného mléka se prakticky nevstřebává. Zeaxanthin a lutein, chrání lidskou retinu před modrým světlem a oxidačním stresem, snižuje též výskyt na věku závislé makulární degenerace.
- Kyselina listová (foláty) intestinální absorpce je hlavně v monoglutarylové formě. V nepřítomnosti ochranných látek jako je vitamin C nebo redukované thioly se labilní foláty ztrácí během vaření nebo v době, kdy jsou v kyselém a peptickém prostředí v žaludku. Nejlépe se vstřebávají foláty z vaječného žloutku, hovězích jater, pomerančové šťávy, méně ze salátu a nejméně z kvasnic. Kyselina listová se inkorporuje spíše do retikulocytů než do zralých erytrocytů.
- Kyselina alfa-lipoová má antioxidační vlastnosti, je absorbována rychle. Během jejího transportu je přeměňována na dihydrolipoovou kyselinu, která má silnější antioxidační účinek. Její transport je závislý na pH, v kyselém prostředí je rychlejší. Její transport je zpomalován zřejmě konkurečními monokarbonovými kyselinami, jako kyselinou benzoovou.
- SELEN Jeho nedostatek působí kardiomyopatii. Hladina v krvi: 1,01 - 1,90 µmol/l. Doporučená suplementace: 50 - 200 µg/den (50 - 200 µg/den). Profylaxe karcinomu: 300 µg/den).
Poločas Se v těle: 65 - 115 dní. Vylučování Se : 60 % močí, 30 % stolicí.
Nedostatek Se může způsobit:
Kongestivní kardiomyopatie (Keshanská choroba) a zvýšenou frekvenci
kardiovaskulárních onemocnění,
Poškození imunity, zvýšené riziko karcinomů,
Poškození reprodukční funkce u mužů Poškození funkce štítné žlázy a zvýšené riziko karcinomu,
Zvýšenou krevní srážlivost, zkrácení života trombocytů.
Na nedostatek Se myslet při:
popáleninách, na ARO, u revmatizmu, malnutrice, alkoholismu, u kuřáků,
akne, u těhotných, u průjmů, u vegetariánů, u renální insuficience aj.
Vysoká dávka selenu jde do svalů, některé orgány mají vyšší metabolickou prioritu pro selen, např. testes. Zatímco biodostupnost transitních kovů vzácně překračuje 20 %, selen z potravy (jak organický, tak anorganický) je absorbován přednostně z 60 % a více, v některých případech dokonce ve 100 % - Zinek Vstřebává se v tenkém střevě.
Denní dávky: 12- 19 mg, děti 50 μg/kg.
Vlastnosti: intracelulární prvek, antioxidant, podporuje množení buněk,
zyšuje buněčnou imunitu, je součástí asi 80 enzymů. Nedostatek Zn působí poruchu tvorby spermií, zhoršuje zrání T-lymfocytů,
nedostatek je u demence, obezity aj. - Měď konkuruje při vstřebávání zinku v tenkém střevě, je z 90% vázána v ceruoplazminu. Denní dávky: 20 μg/kg, bezpečná dávka 15 -30 mg/den. Antioxidačně působí v Cu,Zn- SOD, ale podporuje tvorbu (OH.)
- Chrom 3-mocný snižuje lipoperoxidaci a zvyšuje distribuční objem pro glukózu. 6-mocný je mutagen a karcinogen. Denní potřeba: 50-200 μg/den.
- Mangan cca 10% se ho vstřebává v tenkém střevě, konkuruje absorpci Fe. Nedostatek poškozuje buněčné membrány, oxidovaný Mn se akumuluje v mitochondriích CNS, zvýšený Mn je u nemoci šílených krav.
- Magnesium není antioxidant, ale jeho nedostatek působí pokles vitaminu E v séru. Mg je nutný k biosyntéze GSH. Nízká hladina Mg zvyšuje hladinu intracelulárního Ca →zvýšení katecholaminů a tím i volných radikálů.
- Taurin. Studie prokázaly, že taurin může pomáhat snižovat cholesterol, zvyšovat efektivitu stahů srdečního svalu a zlepšovat krevní oběh a zásobování buněk srdce kyslíkem. Nedostatek taurinu (ten vzniká naoř. z cysteinu) je spojen s úzkostí, epilepsií, hyperaktivitou a depresí; doplňky taurinu mohou tyto příznaky zmírnit. V poslední době bylo prokázáno, že je účinným prostředkem při léčbě alkoholismu, únavy a myotonie. Taurin údajně také chrání zrakové funkce při cukrovce a zlepšuje imunokompetenci. Kromě toho mají taurin a jeho obdoby anti-neurotoxické a protizánětlivé účinky a brání množení nádorových buněk. Ukázalo se také, že taurin chrání různé orgány před poškozením způsobeným psychickým a oxidativním stresem.
- Černý čaj zvyšuje hladinu polyfenolů, katechinu, flavanolů quercetinu a kaempferolu a tím i celkovou antioxidační kapacitu.
- Mateřské mléko je zdrojem antioxidantů pro novorozence, jejichž antioxidační schopnost a tedy jejich ochrana před volnými radikály po porodu mírně klesá.
- Káva má vysokou antioxidační kapacitu (zvláště obsahem polyfenolů a kyseliny chlorogenové, což je ester kyseliny kávové s chinonovou kyselinou, je dobře biodostupná a bioaktivní.
- Cannabinoidy mají antioxidační a protizánětlivý účinek, zvláště CBD.
Dietní referenční příjem antioxidantů
a) stanovený (epidemiologicky zjištěný průměrný příjem)
b) doporučený
c) adekvátní (vyhovující i za zátěžových situací)
d) tolerovaný (maximálně dlouhodobě snášený)
Další význam volných radikálů a antioxidantů je pro transplantace, skladování transfuzní krve, v ORL, kožním, očním lékařství, stomatologii, pracovním lékařství, chirurgii, gynekologii s porodnictvím, možná by redox reakce po smrti přinesly zajímavé poznatky a v dalších oborech.
*************************************************************************************************************
ANTIOXIDANTY A JEJICH GASTROINTESTINÁLNÍ ABSORPCE A INTERFERENCE JEJICH ÚČINKŮ
Antioxidanty a stopové prvky užívají stovky milionů lidí. Účinné jsou
hlavně směsi antioxidantů. Uvádí se složení v tabletách, ale to už dnes
nestačí. Podstatné je, kolik se antioxidantů vstřebá a kde, jak se zvýší
antioxidační kapacita, jaký mají účinek, jaká je jejich stabilita a kdo, kolik,
které a kdy je má užívat. Také je důležité, které antioxidanty při setkání
s volnými radikály působí jako první a tedy jsou nejdříve vyčerpány a zda
vůbec a jak rychle může dojít k jejich zpětné redukci na účinnou složku.
Stárnutím klesá antioxidační kapacita, i roční období má svůj vliv, což je
třeba vzít v úvahu. Vstřebávání a účinek ovlivňuje stav
gastrointestinálního traktu, včetně mikrobiální flóry, pH, velikost molekul,
někdy parciální tlak kyslíku v krvi. Rovněž je velmi důležité, které
antioxidanty během detoxikace volných radikálů reagují jako první a
proto jsou nejdříve vyčerpány a zda vůbec, nebo jak rychle mohou být
redukovány zpět na aktivní komponenty. Volné radikály vznikají
nejčastěji po zátěži a tedy je vhodné, aby antioxidační kapacita před
zátěží byla vysoká, dále během zátěže je možné ji zvyšovat a protože po
zátěži se volné radikály mohou uvolňovat do krve, je vhodné i jejich
podání po výkonu. Někteří autoři doporučují nízké dávky antioxidantů 5x
denně. U některých nemocí se antioxidanty vyplavují do krve ze tkání,
kde je jich pak nedostatek. Důležité jsou interference při vstřebávání,
jejich metabolismus v organismu, který může snižovat jejich hladinu, ale i
zvyšovat jejich účinnost, ovlivňovat do kterých orgánů se ukládají, jak
dlouho se udrží zvýšená antioxidační kapacita. I rychlost vylučování
močí a stolicí je důležitá. Je vhodné vědět, z jakých a z kolika izomérů se
antioxidant skládá, protože jednotlivé izoméry mohou mít rozdílný
účinek. I původ antioxidantů bývá důležitý, přirozené antioxidanty bývají
účinnější než syntetické. Ani toxicitu látek nelze zanedbat. Skladováním
se antioxidanty často znehodnocují, někdy jsou kontaminovány i
anabolickými steroidy, některé látky jako fytáty je mohou vázat a snížit
jejich biodostupnost. V tucích rozpustné látky potřebují v dietě i tukové
složky, některé antioxidanty se rozdílně vstřebávají z různé potravy.
Rovněž genetická výbava člověka je významná.
V uvedeného je patrno, že užívání antioxidantů a stopových prvků není
jednoduché a informace na komerčních preparátech jsou obvykle
nedostatečné, snad v budoucnosti se bude uvádět alespoň celková
antioxidační kapacita.
Antioxidační kapacita ovoce, rostlin apod. je mimo jiné závislá ma intensitě a délce ozáření plodin UV paprsky. Čím je intenzita vyšší, tím více se plodiny musí bránit tvorbou antioxidantů proti volným radikálům. Samozřejmě záleží i na složení půdy, umístění plodin atd. Proto zvláště se hledají výrazné antioxidační plodiny v tropech, ale i u nás můžeme najít vysokou antioxidační kapacitu plodin (např.černý jeřáb).












Oxidoredukční metabolismus u některých frekventovaných nemocí a stavů
Transfuzní lékařství a volné radikály
Covid 19
Virové onemocnění je provázeno oxidačním stresem. Volné radikály oxidují biomolekuly za vzniku energie, kterou virus potřebuje ke svému životu a rozmnožování. Do člověka se dostává přes sliznice, do buněk přes enzymy na povrchu membrán přes receptor ACE (angiotensin konvertující enzym 2) a transmembrání proteázu serin 2 (TMPRSS2). Vstupu do buněk brání vitamin D3, inhibitory ACE (např. kaptopril), foláty a omega-3-mastné kyseliny). Člověk se brání infekci slizniční imunitou, protilátkami jako jsou imunoglobuliny, terapeuticky pak specifickou vakcínou. Naopak virus se brání lipoperoxidací za vzniku malondialdehydu (MDA), který je schopen svými aldehydickýmí skupinami se vázat na volné aminoskupiny proteinů peptidickými vazbami za vzniku velkých molekul a tak neutralizovat jejich protivirové schopnosti. MDA produkují i rostliny, může vzniknout oxidací etanolu a účinkem cyklooxigenázy na membránoví lipidy aj. Na to člověk reaguje tvorbou antiMDA, který za příznivých okolností epigenetickou cestou (antiMDA →RNA→DNA) by se mohl dostat do dědičných vlastností dalších generací. Covid-19 podporuje metabolismus klíčové sloučeniny acetyl-KoA na lipidy místo jeho úplné oxidace v TCA cyklu na vodu a CO2. Lipoperoxidaci a oxidačnímu stresu lze bránit silnými antioxidanty s nízkým redox potenciálem. Další obranou covidu-19 je mutace dusíkatých bazí volnými radikály. Na zmutovaný virus vakciny již nejsou tak účinné jako na původní. Mutacím lze bránit malými molekulami, které jsou schopny volným radikálům poskytnout chybějící elektron (seleničitany, jodidy). Fakta týkající se covidu-19 mohou platit i pro další virová onemocnění. která se projevují oxidačním stresem, jako jsou herpetická onemocnění, hepatitidy, HIV a některé další nemoce. Volné radikály poškozují i bílkovinné receptory pro chuť a čich. Chuťové receptory nejsou jenom na jazyku, ale i v jiných tkáních jako v dýchacích cestách, GIT, pankreatu a mozku.
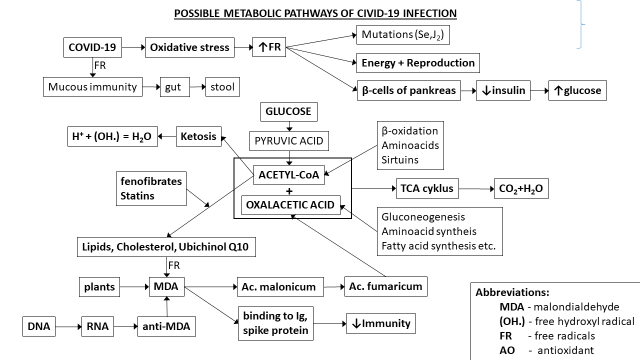
Diabetes mellitus (DM)
Vyskytuje se ve třech hlavních formách: primární (vrozené, autoimunní či idiopatické), sekundární (získané, s převažující poruchou sekrece či působení inzulinu) a gestační. U DM je zvýšená hladina TBARS (thiobarbituric acid reactive substabces) a MDA v séru, vznikají AGE-látky (advanced glycosylation end-products) tzv. glykooxidací (účinkem glukosy a volných radikálů). Je snížená aktivita GPx (glutathion peroxidázy), vázne odbourávání H2O2, který poškozuje β-buňky pankreatu produkující inzulin. Pokles pH zvyšuje účinek volných radikálů. V prediabetickém stadiu bývá vysoká hladina kyseliny močové, při vzniku DM klesá. IL-1 z makrofágů zvyšuje selektivně (NO.) v β-buňkách, což vede k poškození enzymů, obsahujících Fe a S a k snížení produkce energie. Antioxidanty snižují glykovaný Hb, ale ne glykemii. AGE látky se hromadí v proteinech s dlouhým poločasem : retina, myelin, cévní endotel, glomerulární membrány. Diabetické komplikace následují. Tvorbě glykovaných proteinů brání fosfopyridoxal, guanidin, kys. acetylsalicylová, D-lysin (jeho glykací však vzniká karcinogen) aj. Vznik AGE-látek je rychlejší než jejich odbourávání, které probíhá po vazbě na receptor (RAGE). AGE-látky působí lipoperoxidaci, křížové vazby (podobně jako MDA), inaktivují (NO.), stimulují tvorbu cytokinů, podporují vznik VR, působí proliferaci buněk, podporují koagulapatii. U DM paradoxně při hyperglykemii je nedostatek energie pro její nedostatečné využívání a hypoxie, která působí pokles aerobní glykolýzy. Současně je nedostatek redukčního potenciálu, hlavně NADPH, který je intracelulárně spotřebováván volnými radikály a metabolickými pochody.
Nedostatečná funkce inzulinu způsobí narušení transportu glukózy z krve do buňky, což vede k hyperglykémii a zároveň nedostatku glukózy intracelulárně. Nedostatečná utilizace glukózy vede ke změně mechanismů pro zisk ATP. Dochází ke stimulaci glukoneogeneze a glykogenolýzy, v adipocytech se zvyšuje lipolytické štěpení triacylglycerolů na mastné kyseliny a glycerol. Odbouráváním mastných kyselin β-oxidací vzniká nadbytečný acetyl-CoA, z něhož vznikají v játrech ketolátky. Acetacetát může sloužit jako zdroj energie pro činnost svalů a mozku místo glukózy.
Neurodegenerativní choroby
Mozek je nejvíce ohrožen volnými radikály (nízká antioxidační kapacita, hodně polynenasycených mastných kyselin, vysoká potřeba O2 , volné radikály nevratně poškozují neurony).
Poškození lze rozdělit na:
a) nedostatek scavengerů volných radikálů (ALS, migréna (lipoperoxidy působí spasmus mozkových cév), Downův syndrom, deficit GPx (chron. záchvaty, opakované infekce), deficit vit. E (ataxie, slabost, myopatie, demyelinizace), Wilsonova choroba (¯ ceruloplasmin), epilepsie (lze ji vyvolat injekcí FeCl3 do mozku)
b) zánětlivá onemocnění : (encephalitis, meningitis, roztroušená skleróza mozkomíšní (pokles SH-skupin) aj.)
c) hemodynamické poruchy: ( apoplexie, subarachnoidální krvácení ( lipoperoxidace, MDA působí cerebrální vazospazmus), trauma CNS(uvolnění Fe z Hb), hydrocefalus, bolest ( VR a propustnost hematoencephalické bariéry, edém, vzestup prostaglandinů)
d) degenerativní choroby: ( tardivní dyskineza, schizofrenie, myotonická dystrofie, Alzheimerova chroba (¯ SOD, CAT, vitamin C, AOC, lipofuscin, peroxidace bílkovin, AGE-látek, poškození DNA), muscarinové cholinergní neurony jsou kritické pro učení a paměť, lipofilní antioxidanty je chrání) Parkinsonova choroba (oxidační stres, H2O2, Fe, (OH.), Mn).
Neurodegenerativní choroby bývají diagnostikovány poměrně pozdě, kdy změny v mozku způsobené volnými radikály jsou již pokročilé, dále antioxidanty, které by mohly bránit volným radikálům, se těžko dostávají přes mozkomíšní bariéru. Potenciálními pro terapii a prevenci by mohly být směsi antioxidantů jako karotenoidy, vitaminy A, C, D, redukovaný glutathion, pyridoxin, selen, rutin, L-karnosin, kyselina alfa-lipoová, superoxid dismutáza, kataláza nebo jiné. Buňky mají schopnost se bránit před volnými radikály. Problém nastává, když produkce volných radikálů překročí jejich odstraňování antioxidačním systémem. Mozek je během života vystaven excitačním aminokyselinám jako je glutamát, při jehož metabolismu vznikají ROS. Mozek je ohrožen pro svůj obsah velkého množství lipidů a lipoproteinů, podléhajících lipoperoxidaci a pro nízký obsah antioxidantů, z nichž hlavní složkou v mozku je vitamin C, glutathion a thiové deriváty. Nadějné jsou i sloučeniny niacinu a nikotinamidu, rutin, pyridoxin, endavaron, prolaktin, melatonin, nanočástice oxidu ceričitého (v nanočásticích zapouzdřené léky chrání antioxidační enzymy), α-tokoferol umožňuje přenos kvercetinu přes mozkomíšní bariéru, což vede k signifikantnímu vzestupu koncentrace α-tokoferolu a kvercetinu (případně rutinu) v mozku.
Neuroglobin má vysokou afinitu pro kyslík a je v neuronech obratlovců v centrálním i periferním nervovém systému. Neuroglobin působí neuroprotekci neuronálního nebo ischemií způsobeného poškození a udržení funkce mitochondrií.
U depresí je nedostatek serotoninu v interneurálním prostoru. Proto se léčebně podávají inhibitory zpětné rezorpce serotoninu nebo inhibitory monoaminoxidázy (IMAO), které brání oxidaci serotoninu. Bylo by jistě vhodné vyzkoušet i antioxidanty, které by bránily oxidaci serotoninu volnými radikály. Metabolismem tryptofánu přes serotonin, melatonin a indoxylový radikál vzniká N-metoxy N-acetyl, N-formylkynurenin.
Mezi neurodegenerativní choroby patří:
Alzheimerova choroba
Je charakterizována neuronální degenerací a poruchou poznávání zvláště u starých lidí. V patogeneze Alzheimerovy choroby je oxidační stres, který působí neurodegenerativní poškození a tvorbu plaků v CNS, je zvýšená lipoperoxidace i v mozku. Byla vyslovena hypotéza, že protein amyloidu, hlavní složka senilních plaků, je neurotoxická a tato toxicita je způsobena volnými radikály. Pro terapii jsou vhodné rutin, vitamin E, C, pro kognitivní funkce pak vitamin E a C, beta karoten. Podávání vysokých dávek vitaminu E prodloužilo dobu, než vznikly klinické symptomy nemoci.
Parkinsonova choroba
Je neurodegenerativní onemocnění centrální nervové soustavy, které přímo souvisí s úbytkem nervových buněk v části mozku nazvané substantia nigra. Tyto buňky za normálního stavu produkují dopamin, což je neurotransmiter, který zajišťuje přenos signálů mezi nervovými buňkami. Nedostatek dopaminu způsobuje, že pacient postupně není schopen ovládat nebo kontrolovat svůj pohyb. I nedostatek antioxidantu vitaminu E přispívá k nigrální neurodegeneraci a k nástupu onemocnění Parkinsonovou chorobou. V poslední době je nadějný výzkum vztahu Parkinsonovy choroby a imunitního systému. Pro terapii jsou vhodné vitaminy E, C, A, E, beta karoten, flavonoidy a redukovný glutathion (GSH).
Sclerosis multiplex
Je chronické autoimunitní onemocnění, při kterém lidský imunitní systém napadá centrální nervovou soustavu (mozek a míchu), čímž způsobuje demyelinizaci (rozpad myelinových pochev). Roztroušená skleróza vykazuje zánětlivé autoimunní poškození, což zahrnuje i poškození mozkomíšní (MM) bariéry. Roztroušená skleróza ovlivňuje schopnost neuronů v mozku a míše spolu vzájemně komunikovat. Nervové buňky spolu komunikují prostřednictvím vysílání nervových vzruchů přes axony (neurity), které jsou obaleny v izolační látce nazývané myelin. Ten významně urychluje vedení nervového vzruchu a zabraňuje jeho přenosu na okolní vlákna a struktury. Při roztroušené skleróza napadá imunitní systém myelin a ničí jej. Tak axony nejsou schopny přenášet nervové vzruchy. Vzplanutí přidružené oxidace v aktivované mikroglii, zánět a aktivované makrofágy hrají významnou roli v demyelinizaci a poškození tkáné volnými radikály v patogeneze roztroušené sklerózy. Zánětlivé prostředí v lezích demyelinizace vede k tvorbě kyslíkových a dusíkových radikálů a prozánětlivých cytokinů, což přispívá ke vzniku a progresi nemoci. Oxidační stress a zánět se opakují v cyklech. Roztroušená skleróza se vyskytuje častěji v oblastech, které jsou méně vystaveny slunečnímu světlu. Antioxidant melatonin se dostává přes MM bariéru a má antioxidační, imunomodulační a protizánětlivé účinky. 80-90% pacientů s mnohočetnou sklerózou má chronický únavový syndrom.
Amyotrofická laterální skleróza
Je smrtelné, progresivní neurodegenerativní onemocnění mozku. Dochází k degeneraci a postupné ztrátě mozkových a spinálních motoneuronů vůlí ovládajících svalů. Jiné nervy poškozeny nejsou, takže pacient má zachované mentální i psychické schopnosti. Nemoc začíná slabostí končetinových svalů, pokračuje až jejich atrofií, dochází k bulbárním symptomům včetně dysfagie, dysartrie, poruchami hlasu, dysfonie a poruchami dýchacích cest jako zhoršenou ventilací. Smrt obvykle nastává za 3-5 let. V současné době jako hlavní příčina onemocnění se jeví volné radikály. Rekombinantní proteiny se agregují v mozku a tvoří β-amyloid bohatý na fibrily. Ochrana před oxidačním stresem a odstranění poškozených bílkovin se jeví perspektivně. Pro terapii je jeví vhodný koktejl antioxidantů.
Huntingtonova choroba
Je vzácné dědičné neurodegenerativní onemocnění mozku charakteristické nekoordinovanými trhavými pohyby těla a snížením mentálních schopností Tyto příznaky se u jednotlivců mohou lišit, rozdílný průběh poklesu mentálních schopností může vést k řadě potenciálních problémů, které vyžadují soustavnou ošetřovatelskou péči. Samotná nemoc není smrtelná, ale výrazně oslabuje imunitní systém, a tak snižuje průměrnou délku života. Etiologií onemocnění je oxidační neurotoxicita. Podle jedné studie podání alfa-tokoferolu v časném stadiu Huntingtonovy choroby může zpomalit motorickou dysfunkci.
Schizofrenie a tardivní dyskineza
U obou byl nalezen nadbytek ROS. Oxidační stres je ve schizofrenii potvrzen vzestupem lipoperoxidace v plazmě i CNS a změněnými aktivitami enzymových i neenzymových antioxidantů u chronické první epizódy pacienta. Dále schizofrenický pacient má nižší hladiny plazmatické kyseliny močové, je korelace s klinickým stavem. Tardivní dyskinéza je u pacientů léčených chronicky neuroleptiky jako haloperidolem. Ten usnadňuje striatální glutaminergní neurotransmise blokováním presynaptických dopaminových receptorů, což vede k neuronálnímu poškození vlivem oxidačního stresu. Pro terapii lze použít vitamin E.
Chronický únavový syndrom (CFS)
Symptomy jsou únava, neosvěžující spánek, svalová a kloubní bolest, bolest v krku, hlavy, problémy s poznáváním, duševní a fyzická vyčerpanost (poruchy paměti a koncentrace). Dále svalová slabost, zvýšená citlivost na světlo, oteklé lymfatické uzliny, respirační a srdeční problémy a jiné. Významným nálezem u CFS je průkaz zvýšeného oxidačního stresu. To podporuje myšlenku, že by antioxidanty mohly hrát významnou roli v terapii CFS.
Migréna
Je onemocnění projevující se obvykle jednostrannou bolestí hlavy, zvracením, poruchou vidění, slabostí aj. Často je bolest vyvolána kouřením, silným hlukem, blikajícím světlem, stresem, úzkostí aj. a předchází ji tzv. aura. V mozku nastává vasodilatace (tlak na nervy), hyperemie, neurogenní zánět s vyplavením zánětlivých cytokinů, je nedostatek magnesia. Při vyplavení serotoninu dojde k vasokonstrikčnímu efektu v mozku, což může společně se zánětem a následnou hyperemií a dalšími stavy vyvolat zvýšenou genezi volných radikálů. V terapii je navrženo mnoho léků, nejvýznamnější jsou triptany, ale i hluboké dýchání, ginkgo biloba, Mg, Ca, vitamin D často pomáhají. Vliv antioxidantů nebyl dosud řádně vyzkoušen.
Hydrocephalus
U dětí s hydrocefalem se aktivují volně radikálové reakce, lipoperoxidace a klesá antioxidační kapacita. V mozkomíšním moku byla nalezena zvýšená koncentrace neopterinu a 7,8-dihydroneopterinu u pacientů s neurodegenerativními chorobami a infekcemi CNS.
Záněty
Rozeznáváme záněty akutní a chronický. Akutní zánět je odpověď na náhlé poškození, chronický je pokračováním akutního, ale už bez zevního ohrožení. Jestliže je tělo napadeno viry, bakteriemi nebo toxickými chemikáliemi, brání se zánětlivými buňkami a cytokiny (látky, které stimulují další zánětlivé buňky). Výsledkem je bolest, otok, zčervenání atd. Vznikající volné radikály (VR) zabíjí napadající mikroorganismy, ale poškozují i tkáně. Jestliže tělo aktivuje imunitní systém, vysílá zánětlivé buňky. Leukocyty uvolňují superoxid, stoupá peroxid vodíku. Uvolňují se cytokiny, tvoří se prostaglandiny, leukotrieny atd. VR blokují látky, které brání štěpení bílkovin, uvolňuje se např. elastáza, kolagenáza aj. Zánět podporující cytokiny (prozánětlivé), včetně chemokinů jsou: TNF, IL-1, IL-4,IL-6, IL-8, IL-12, zánět inhibující cytokiny (protizánětlivé) jsou : IL-6, IL-10, TGF-β. Resolviny a maresiny jsou lipidové mediátory s protizánětovými a reparačními účinky vzniklé přeměnou ω-3 nenasycených mastných kyselin. Endogenní lipidové mediátory vykazují velmi silné protizánětové a zánět vstřebávající vlastnosti. Dokáží ovlivnit sílu a délku akutní zánětové odpovědi. Resolviny, maresiny aj. působí omezení prostupu leukocytů, snížení syntézy prozánětových cytokinů a exprese adhezních molekul, zvýšení odstraňování apoptotických buněk a mikrobů makrofágy, podporu tkáňové reparace a hojení. Tyto lipidové mediátory mají značný potenciál v léčbě zánětových onemocnění různého původu.
Terapeuticky z hlediska volných radikálů je vhodné použít vitaminy A,C,D. Zinek snižuje zánět a usnadňuje opravy. Vhodné jsou též česnek, kurkuma a zázvor.
Transfuzní lékařství a volné radikály
Volné radikály zkracují dobu skladování krve, méně se uvolňuje draslík z erytrocytů apod. Odstraněním leukocytů se významně snižuje přítomnost volných radikálů. Antioxidanty zlepšují kvalitu skladované transfuzní krve např. mně se uvolní draslíku z erytrocytů apod. Suplementace antioxidanty u dárců krve před odběrem činí krev kvalitnější, což by mohlo mít význam pro transfuze především u malých dětí.
Transplantace orgánů
Po odebrání orgánu dárce dochází ke dvěma stadiim:
teplá ischemie – od přerušení cirkulace po promytí hypotermickým roztokem. Reperfuze – vznik volných radikálů, rozvoj hlavního poškození.
studená ischemie – hypotermický stav (ochlazení na 0ºC ↓metabolismus až 12x, spec. prezervační roztoky s antioxidanty, lze i stálé promývání, imitace funkce.
Srpkovitá anemie
Postižené erytrocyty zpomalují krevní oběh nebo ho přímo blokují. Vazo-okluzivní krize nastává při okluzi kapilár a snížení krevního oběhu. Dochází k ischemii, bolesti, nekróze, případně poškození orgánů, hemolytická krize vede k oxidačnímu stresu erytrocytů, leukocytů a krevních destiček. Oxidační stres může způsobit anemii vlivem nerovnováhy hladiny kyslíku ve tkáních. V terapii se doporučují mj. antioxidanty, kyselina listová a hydroxyurea.
Kožní lékařství:
Šedivění vlasů:
Vlasové folikly vlivem syntézy melaninu generují silný oxidační stres.Vlasové váčky melanocytů jsou zvláště citlivé na volné radikály. Docházík apoptóze melanocytů a oxidačnímu stresu v pigmentační jednotcešedivějících vlasových foliklů, což vede k selektivnímu předčasnémustárnutí a apoptóze.Možnost: zpomalit proces šedivění, případně ho zastavit podávánímsměsi antioxidantů, sirtuinů, resveratrolu a nikotinamidmononukleotidu.
Alopecia seborrhoica:
Kůže na temeni hlavy zvláště u mužů je často vystavena tlaku, resp.ischemii. Po ní dochází k reperfuzi a výrazné produkci volných. (Po stranách hlavy k ischemii dochází spíš zřídka). Volné radikály působí na lipoproteiny v mazových žlázkách vlasových foliklů,vzniká lipoperoxidace a apoptóze vlasových kořínků s následným defluviem.
Kožní nádory:
jsou vyvolávány nadměrným ozařováním UVA a UVB paprsky, které snižují kožní antioxidační obranu.
Popáleniny:
30 % kůže těla působí oxidační stres, který se projevív plicích vzestupem malondialdehydu (MDA) o 29 %,, dále poklesem o 13 % GSH a o 33 % vzestupem GSSG. Klesá aktivita glutathion peroxidázy o 27 %, glutathiom-S-transferázy o 23 % a glutathion reduktázy o 19 %. Rovněž v exudátu je signifikantně více MDA než v transudátu.
Oční lékařství
Katarakta:
Vlivem volných radikálů se bílkoviny v oční čočce začínají kalit (šedý zákal. Rizikovými faktory jsou stavy, kdy vznikají volné radikály jako např. DM 2. typu, kouření, alkohol, vystavování se slunci.
Makulární degenerace:
Makulární degenerace je nemoc, která je hlavní příčinou slepoty ve vyšším věku. Trpí jí asi čtvrtina lidí nad 50 let.
Její rozvoj podporují civilizační choroby, například cukrovka a ateroskleróza nebo negativní životní návyky což je kouření, zvýšená zraková námaha, nedostatek pohybu popřípadě obezita. Vyskytuje se ve dvou formách:
Suchá forma vyskytuje se až u 90 % pacientů, vede ke zhoršenému vidění, dochází pozvolna.
Vlhká forma objevuje se méně často, ale zato je mnohem závažnější a progresivnější. Vede ve většinovém procentu případů k úplné ztrátě zraku.
Terapeuticky je velice důležitý například dostatek vitamínů ve stravě, zejména vitamínu C, E a betakarotenu. Podává se také oxid ceričitý.
Bolest – viz Redox metabolismus-.1
Kardiovaskulární choroby
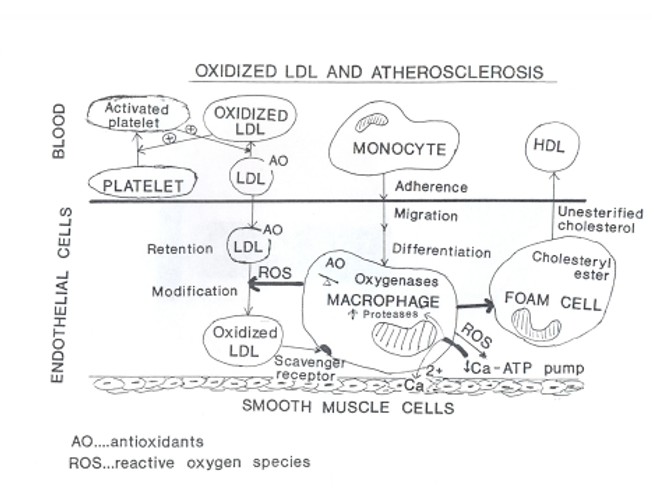
Atheroskleróza:
Volné radikály se účastní vzniku aterosklerózy. Receptory pro LDL-cholesterol na buňkách ho zachycují a intracelulárně je zpracováván. Pokud je LDL oxidován volnými radikály, receptory ho nepoznají a je z krve odstraňován scavengerovými receptory makrofágů. Ty odstraňují i další modifikované molekuly LDL-cholesterolu. Blokáda těchto receptorů znemožňuje vznik pěnových buněk. V organismu vznikají též protilátky proti modifikovaným LDL, které chrání organismus před škodlivými jejich účinky. V makrofazích se hromadí volné radikály, cholesterol, snižuje se výkon Ca-ATP pumpy, tím se zvyšuje intracelulární Ca, aktivují se proteázy s následným štěpením bílkovin za vzniku pěnové buňky, základ aterosklerózy.
Dalším postupem vzniká endotelová dysfunce. Epidemiologický výzkum účinku antioxidantů pro vznik a rozvoj aterosklerózy neprokázal příznivý účinek vitaminů C a E, ale nebylo vzato v úvahu mnoho faktorů.
Infarkt myokardu:
Při infarktu myokardu dochází mj. k hypoxii s následnou reperfuzí, při čemž se generují četné volné radikály, mj. singletový kyslík. V dřívějších pokusech jsme stanovili, že promyté erytrocyty v prostředí glukózy a nikotinové kyseliny po inkubaci dávají nikotinamidmononukleotid (NMN). Redukované formy NMNH, NADH a NADPH účinkují jako antioxidanty proti vzniklým volným radikálům a tím zabraňují poškození tkání lipoperoxidací, oxidací proteinů a mutaci RNA a DNA. NMN inhibuje záněty cév. Dále je známo, že stresové stavy podporují i biosyntézu sirtuinů, které podle nových výzkumů prodlužují délku života a ke své činnosti potřebují NMN. To vše slouží jako obrana organismu před poškozením. Aktivátorem genů sirtuinů je např. resveratrol, který je však špatně rozpustný ve vodě, proto se podává s jogurtem nebo olivovým olejem. Nutné je pro ovlivnění délky života vedle NMN podávat i resveratrol. Zvýšená exprese sirtuinu 3 (SIRT3) přispívá k ferroptóze, zatímco pokles SIRT3 vede k poklesu ferroptózy a autofagie a zvýšení hladiny glutathion peroxidázy 4. (Ferroptóza je typ programované buněčné smrti závislé na železe a charakteristické akumulací lipidových peroxidů, liší se od jiných buněčných smrtí jako je nekróza nebo apoptóza. Ferroptóza je iniciována poškozením antioxidační na glutathionu závislé obrany.) Možnost: U infarktu myokardu a jiných závažných poškození aplikovat směs antioxidantů, nikotinamid, resveratrol a proti singletovému kyslíku histidin, glutathion, beta-karoten, selen či proteiny.
Sport
Sportovní výkon je provázen vysokou tvorbou volných radikálů. Proto špičkový sportovní výkon vyžaduje velké množství antioxidantů, vlastní zásoba obvykle nestačí a je proto třeba antioxidanty suplementovat jak před výkonem, tak po výkonu. Hlavní důvody tvorby volných radikálů jsou reperfuze po předchozím nepoměru mezi zvýšenými požadavky organismu na okamžitou možnost zásobovat jej kyslíkem, rozpadem buněk, zvláště bílých krvinek, oxidací purinových bazí DNA, stresem, vyplavením adrenalinu, uvolňováním volného železa, sval se při extrémní námaze může zahřát až na 45°C, vzniklým zánětem, případně příjmem volných radikálů z okolního prostředí. Peroxidují se lipidy, bílkoviny, poškozují DNA aj. K odstraňování volných radikálků jsou spotřebovávány antioxidany, uvolňují se antioxidační enzymy do krevní plazmy, stoupá intracelulární kalcium, zvyšuje se tvorba oxidu dusnatého, stoupá hladina peroxidu vodíku a kyseliny chlorné. Ty pronikají membránami a působí oxidační poškození tkání. Kosterní svaly obsahují asi 4 % fenylalaninu, který je zvláště citlivý na poškození volnými radikály. Volné radikály poškozují buněčné membrány, což může způsobit uvolňování důležitých látek z buněk (enzymů apod.), látek působících zánětlivou reakci, vznikají tromboxany, které podporují srážení krve a působí vazokonstrikci (zúžení cév). Tím zpomalují svalovou regeneraci po výkonu. Poškození buněk může způsobit až smrt buněk. Tréninkem dochází k opakovaným stavům svalové hypoxie (nedostatku kyslíku ve svalech). To podporuje tvorbu tzv. heat shock proteinů, které umožňují sportovcům hypoxie lépe snášet. Dostatečná antioxidační ochrana zabraňuje ztrátám důležitých látek ze svalových buněk (jako jsou kreatinkináza, myoglobin), což výrazně zmenšuje poškození svalových buněk volnými radikály, tím se urychluje regenerace a zkracuje svalová únava. Oblíbená rehabilitace ochlazení svalů po výkonu ledovou tříští zpomalí produkci volných radikálů, takže antioxidanty mají více času volné radikály zneškodnit a tkáně jsou méně poškozovány. Tréninkem stoupá schopnost organismu vyrovnat se se zvýšenou zátěží volnými radikály. Adaptační schopnost sportovců je vysoká a výrazně snižuje oxidační stres během výkonu. Ve svalech a nohách jsou dvojí vlákna: bílá (rychlostní) a červená (vytrvalostní). Bílá vlákna jsou citlivá na volné radikály, a proto s věkem jich ubývá. Fyzická námaha a další vlivy generují volné radikály, bílá vlákna lze chránit před radikály směsí antioxidantů. Množství antioxidantů po intensivním výkonu může klesnout ve svalu až o 40%, stejně i sportovní výkon, klesá i imunita. Ve svalu během intenzivního výkonu klesá pH, stoupá laktát, silně klesá glykogen, zvyšuje se oxidace mastných kyselin, což vše vede k únavě. Nedostatek kyslíku ve tkáních se projevuje u horolezců vysokých hor, sportovního potápění, u spritérských disciplin s kyslíkovým dluhem a tedy i u fotbalistů. Vlivem volných radikálů se z látek obsahujících železo (např. erytrocytů) toto uvolňuje a to i následkem menší mechanické hemolýzy (např. na ploskách nohou při dlouhém běhu) do séra, což působí tzv. Fentonovu reakci vznik volného hydroxylového radikálu. Svalové vlákno ze srdce (myocyt) produkuje oxid dusnatý. Ten rozšiřuje cévy a zlepšuje srdeční činnost. Velmi intenzivní srdeční činnost ovšem může vznik oxidu dusnatého zmenšit. Hráči, kteří jsou náchylní ke svalovým křečím, produkují více oxidu dusnatého a mají větší poškození svalů, jsou dehydratovaní a ze svalů se jim více uvolňují některé enzymy jako CK, AST, ALT a LD, ale i ionty K, Mg, Zn. Je výhodnější, že trénovaný sportovec relativně více zvyšuje krevní tlak než počet pulzů. Též produkuje méně peroxidu vodíku a kyseliny chlorné, které oxidují tkáně. Možnost: Podávat sportovcům, zvláště starším směs antioxidantů a tak udržovat jejich rychlostní vlastnosti.
Vhodný pohyb prodlužuje život, ale neoddaluje stárnutí (mezi stoletými nebývají olympionici).
Plicní choroby a kouření
OZÓN :
(OH.), O3 . - aj. ¯ AOC
Fibromuskulární plicní dysplasie:
u nedonošenců je nedokončený vývoj antioxidačního enzymového systému
Bronchiální astma:
ROS, Intersticiální plicní fibróza: Oxidační stres ® buněčné poškození, zánět, fibrózy.
Cystická fibróza:
VR z leukocytů ®aktivace proteáz, plicní fibróza, bronchiektazie
Chronická obstrukční plicní nemoc (CHOPN):
U CHOPN je patrné zúžení bronchiolů, destrukce alveolů zánětem a vznik emfyzému.
Rizikové faktory: kouření, znečištění ovzduší, deficit α1-antitrypsinu. Hlavním rysem CHOPN je bronchiální obstrukce (omezený průtok vzduchu v průduškách), která není plně reverzibilní. Vzniká na podkladě abnormální zánětlivé reakce na škodlivé látky a plyny ve vdechovaném vzduchu. Příznaky CHOPN: kašel – obvykle celý den, zřídka jen v noci; expektorace (vykašlávání hlenu) – chronická tvorba sputa; dušnost, která má sklon k progresi; snížení tolerance fyzické námahy (navazuje na dušnost).
Plíce, do kterých se dostává kyslík v nejvyšší koncentraci a které jsou tedy ohroženy tvorbou volných kyslíkových radikálů nejvíce, jsou fylogeneticky vybaveny nejsilnější antioxidační obranou. Velké množství volných radikálů je zneškodňováno velkým množstvím antioxidantů, ale lokálně může dojít k tomu, že antioxidační obrana nestačí, nebo chybí proti některému z agresivních volných radikálů. Do plicních alveolů se dostávají mikročástečky prachu, pokud jsou menší než 5 µm, kde mohou být fagocytovány makrofágy. Volné radikály jsou produkovány nejvíce křemičitým, olověným a asbestovým prachem. Nemoci plic, u kterých je doložena účast volných radikálů v patogeneze: ARDS - syndrom dechové tísně dospělých.
V tekutině získané z bronchoalveolární laváže je rovněž zvýšená aktivita myeloperoxidázy (MPO), která může indukovat peroxidu vodíku ve vydechovaném vzduchu a vznik kyseliny chlorné. Oxidanty se uvolňují i z četných neutrofilů v alveolárních prostorech, 7alveolární koncentrace glutathionu je snížena. Přítok sérových proteinů s antioxidačními vlastnostmi, ke kterému docházi při plicním edému, může ochránit plíci před dalším poškozováním volnými radikály.
Fibrotizujíci alveolitida: U této nemoci uvolňují neutrofily a další zánétlivé buňky zvýšené množství superoxidu a H2 O2. V bronchoalveolární tekutině se nachází zvýšená aktivita myeloperoxidázy (MPO), která je zdrojem kyslíkových radikálů. Současně dochází i ke snížení hladin glutathionu v lavážni tekutině.
Plicní rozedma: Hlavním podílem je kouření. Volné radikály se uplatňují při postižení plic u intoxikovaných paraquatem, oxidy dusíku při radiační pneumonitidě, u pneumokonióz (sililkóza, azbestóza) a u polékových poškození plic (antracyklinová cytostatika, nitrofurantoin, bleomycin).
KOUŘENÍ:
Vlivem kouření, nalézáme ¯ AOC, vitamin C a E, GSH, b-karoten, elastáza - vznik emfyzému, zvýšená adhezivita monocytů na cévní endotel ARDS: H2O2 , nefunkční a1-antitrypsin ¯ AOC,GSH. Cigaretový kouř inhibuje katalázu a tím zvyšuje oxidační stres. Lykopen, α-tokoferol a retinol nemají své hladiny signifikantně odlišné od nekuřáků. Ovšem podání vitaminu E zvýší jeho hladinu více u nekuřáků než u kuřáků. Kadmium z cigaret snižuje v buňkách hladinu GSH a ATP. Glutathion chrání před toxickým vlivem kadmia. Kouření snižuje obranný mechanismus před singletovým kyslíkem. Přestane-li kuřák s kouřením upraví se poměrně brzy hladina vitaminu C, γ-tokoferolu, β-karotenu, ale i antioxidační kapacita (AOC) v plazmě, ale nikoliv oxidace LDL-cholesterolu a dalších ukazatelů. Účinek kouření na respirační cesty.
V cigaretovém kouři je obsaženo více než 1000, někteří autoři uvádí dokonce až 4000 různých látek. Kouření je velkým zdrojem volných radikálů. 1 cigareta představuje příjem 1017 volných radikálů. Volné radikály z cigaretového kouře představují hlavně superoxid a alkoxylové a alkylové radikály, volný hydroxylový radikál, různé organické radikály, ale i tzv. ROS látky. Patří sem peroxid vodíku, který proniká i přes buněčné membrány, singletový kyslík, elektronicky excitovaný stav kyslíku s chemickou reaktivitou aj. Všechny tyto látky jsou velmi reaktivní. Jeden z nejagresivnějších volných radikálů – volný hydroxylový radikál (OH.) – má poločas 10-9 s. Volné radikály z cigaretového kouře působí lipoperoxidaci, vzniklé produkty lipoperoxidace neslouží již jako plnohodnotné lipidy. Lipofusciny se postupně ukládají (stařecké zabarvení kůže). Superoxid s oxidem dusnatým tvoří peroxynitrity, ty nitrují organické molekuly a tím je poškozují. Prokazují se obvykle jako nitrotyrosiny. Bílkoviny s dlouhým poločasem trvání jsou touto přeměnou nejvíce poškozeny (např. myelin z nervové tkáně, bílkoviny retiny, glomerulární membrány, cévního endotelu – tedy orgány postižené nejčastěji u diabetu). U kuřáků je vyšší hladina asymetrického dimetylargininu v plazmě, což je rizikový faktor kardiovaskulárních chorob.
Částečky z cigaretového kouře ulpívají na povrchu epiteliálních plicních buněk, adhezi mohou snížit scavengery ROS.
Cigaretový kouř podporuje fibrogenní účinek asbestu. Částečky z kouře, ale i ozón zvyšují zánětlivou reakci, zvětšují proliferaci buněk a uvolňují zvýšené hladiny chemoatraktivních a vaskulárních mediátorů, jako např. endotelinu. Nejdůležitějšími antioxidanty v plicích jsou glutathion, vitaminy C a E, beta-karoten, kyselina močová a enzymy SOD, kataláza a peroxidázy. Dále jsou to různé proteiny jako peroxiredoxiny, thioredoxiny, glutaredoxiny a hemové oxygenázy a reduktázy. Poruchy oxidoredukční rovnováhy mohou podporovat onemocnění plic, jako chronickou obstrukční plicní nemoc (CHOPN), astma, idiopatickou plicní fibrózu aj. Např. u kuřáků s pneumonií ve vydechovaném vzduchu jsou zvýšené TBARS, jako následek účinku volných radikálů, ale je snížený peroxid vodíku. U astmatu je deregulována iNOS (nitroxid syntáza) a tito lidé exhalují jen nízké koncentrace NO. Nikotin zvyšuje arginázu I a ornithin dekarboxylázu v dýchacích cestách, což může mít souvislost s CHOPN. Kouření interferuje s metabolismem L-argininu a NO. ROS stoupají v dýchacích cestách při inhalaci čistého kyslíku nebo cigaretového kouře, což podporuje vznik trancheobronchitidy. Dochází k aktivaci makrofágů u kuřáků, což je ovšem klíčový projev zánětlivé reakce. Makrofágy stimulující protein (MSP) zvyšuje produkci superoxidu, uvolňování cytokinů IL-1β, IL-10, TNFα a aktivaci NF-κB. Tento účinek lze snížit protilátkou proti MSP. Jako první obrana proti ROS účinkuje extracelulární glutathionperoxidáza, kterou syntezuje epitel dýchacích cest a alveolární makrofágy do povrchového epiteliálního bronchiálního sekretu. NO, produkovaný NO syntázou 2 se rychle váže na ROS a vytváří volné dusíkaté radikály (RNS). Těžcí kuřáci mají sníženou schopnost alveolárních makrofágů produkovat ROS. Efekt glukokortikoidů snižovat produkci ROS buňkami bronchoalveolární laváže u CHOPN se však nejeví jako významný. Epiteliální buňky na alveolárním povrchu lidských dolních cest dýchacích jsou zranitelné toxickými oxidanty. I když tyto buňky obsahují intracelulární antioxidanty, jejich ochrana před oxidanty bývá neschopná ochránit epiteliální povrch. Proto epiteliální bronchiální sekret dolních cest dýchacích obsahuje velké množství sulfhydrilových skupin, specielně redukovaného glutathionu. Toho je z celkového množství glutathionu 96% v redukované formě a je ho 140x více než v plazmě téhož člověka. Kuřáci jako kompenzaci oproti nekuřákům mají v bronchiálním sekretu více GSH a toto množství obvykle stačí chránit buňky před přebytkem ROS, hlavně peroxidem vodíku. Reakce myeloperoxidázy a peroxidu vodíku má schopnost inaktivovat inhibitor alfa 1 proteinazy, takže dochází k porušení rovnováhy proteázové a antiproteázové rovnováhy v plicích. Ochranu před oxidativní inaktivací inhibitoru alfa 1 proteinázy a tím kuřáckého emfyzému skýtá glutathion, který odstraňuje hlavně v této reakci peroxid vodíku. Kuřáci mají i zvýšený počet neutrofilů v dolních cestách dýchacích. Velkou roli hrají v patogeneze emfyzému alveolární makrofágy. V dolních cestách dýchacích dojde k relativní převaze neutrofilní elastázy nad anti-neutrofilní elastázou, hlavně zastoupenou alfa-1-antitrypsinem. Elastáza tak může poškozovat alveolární struktury a vést k plicnímu emfyzému. Na inaktivaci alfa-1-antitrypsinu se podílí hlavně alveolární makrofágy kuřáků, které produkují superoxid a peroxid vodíku v mnohem větší míře než u nekuřáků, též protože je snížená antioxidační kapacita alveolárních makrofágů hlavně u starších kuřáků. Superoxid s oxidem dusnatým reaguje vznikem peroxynitritu (ONOO- ), který může nitrovat makromolekuly. Už po 3 vdechnutích cigaretového kouře alveolární makrofágy produkují do 30 minut peroxynitrit! Při vdechnutí kouře je poměr NO/ONOO- 2 : 1, ale ve vydechovaném vzduchu 1 : 9. Ve vydechovaném vzduchu je též pentan, který vzniká z 6ω- PUFA (polynenasycené mastné kyseliny) a etan z 3ω-PUFA. Množství etanu je úměrné kouření, v játrech se etan odbourává pomaleji než pentan. Snížená je mj. aktivita Cu,Zn-SOD, glutathion S-transferázy a glutathionperoxidázy. Peroxynitrit nitruje tyrosin na 3-nitrotyrosin, modifikuje tak plazmatické lipoproteiny a podporuje vznik aterosklerózy. Protektivně může působit SOD a kataláza, které snižují inaktivaci alfa-1-antitrypsinu. Cigaretový kouř se uvádí jako častá příčina plicního emfyzému, ale nevzniká u všech kuřáků. Oxidační stres je příčinou poškození alveolárních fibroblastů, ale existuje individuální variabilita mezi lidskými fibroblasty a proto i velké rozdíly ve velikosti poškození plic. Za smrt fibroblastů u kuřáků je zodpovědný oxidační stres a apoptóza. Zřejmě záleží na GSH, případně podaném N-acetyl-L-cysteinu, které chrání fibroblasty před poškozením. N-acetyl-L-cystein však může mít i určité vedlejší prooxidační účinky. Cigaretový kouř zvětšuje indukci respiračních mucinů prozánětlivými stimuly u chronické obstrukční plicní nemoci (CHOPN) a přispívá k hyperprodukci mucinu. Ve Skotsku po zákazu kouření ve veřejných místnostech poklesl počet respiračních a sensorických symptomů u zaměstnanců o téměř 25%. Snížil se i počet bílých krvinek, zlepšily se i některé spirometrické hodnoty, je méně zánětů dýchacích cest a snížilo se i množství exhalovaného NO v dechu. V Kanadě z kuřáků je asi 30% astmatiků. Při hypoxii jak β-karoten, tak α-tokoferol a kyselina askorbová mají antioxidační schopnost. Jejich směs má silnější antioxidační účinek než jednotlivé složky. Při vysoké tenzi kyslíku však dochází ke stoupání lipoperoxidace, oxidace proteinů i poškození DNA, tedy dochází k prooxidačnímu účinku.
Nádorová onemocnění podporovaná kouřením Jednou z příčin vzniku nádorů jsou nepochybně právě volné radikály. Mohou těžce poškodit DNA a/nebo mutovat DNA. Kouř z cigaret potlačuje tvorbu plicních T-lymfocytů, takže se zvyšuje náchylnost k respiračním infekcím a vzniku nádorů. Vystavení lidských T-buněk dehtu z cigaret působí okamžitý pokles syntézy DNA. Bronchopulmonální epiteliální buňky představují první a nejdůležitější linii ochrany před cigaretovým kouřem. Cigaretový kouř lze rozdělit na 2 fáze: plynnou a pevnou (dehet). Obě jsou škodlivé a obsahují vysoké koncentrace toxických a karcinogenních látek. V méně kvalitních cigaretách mohou být i pesticidy. Plynná fáze působí hlavně na bronchopulmonální epiteliální buňky. Na každých 500 ml vdechnutého vzduchu při kouření připadá asi 35 ml cigaretového kouře. 350 ml se vydechne a 150 ml se dostane do bronchů. Při každém vdechu bez kouře se zředí cigaretový kouř cca 14x, dokud opět se nevdechne další kouř. Tedy dochází k velkému zředění cigaretového kouře. Denně průměrný člověk inhaluje přibližně 1010 prachových částic. Toto množství se výrazně zvyšuje u kuřáků. Dehtové částečky o průměru 0,2 – 5 μm se deponují v tekutině, která pokrývá řasinky bronchopulmonálního epitelu. Mucus, který je zdrojem důležitých antioxidantů, chrání dýchací cesty od trachey až po konec bronchiolů. Každá bronchoepiteliální buňky má 200 řasinek. Tyto řasinky se kontinuálně pohybují směrem k laryngu a odstraňují mucus. Dehtové částečky zvyšují produkci mucusu a aktivují čistící mechanismus. Pokud je tento ochranný účinem řasinek toxickými látkami poškozen, takže je jejich pohyb paralyzován, stávají se buňky cílem toxických a kancerogenních částeček. Ke ztrátě řasinek dojde např. účinkem akroleinu nebo oxidu dusičitého. Mucus není odstraňován, mění svou viskozitu, řasinky se totiž nepohybují. Tak lokálně může vzniknout příznivá situace pro vznik nádoru. Plynná fáze cigaretového kouře obsahuje genotoxické komponenty a inhibitory opravy DNA. Toxické a kancerogenní látky v cigaretovém kouři jsou některé uhlohydráty (etylen, butadien, izopren aj.), aldehydy a ketony (acetaldehyd, akrolein, aceton aj.), nitrily a aminy (etylnitril, fenylamin aj.), aromatické uhlohydráty (benzen, toluen, styren aj.), heterocyklické sloučeniny obsahující kyslík (furany aj.) a další plynné i neorganické látky (oxid siřičitý, oxid uhelnatý, amoniak, kyanovodík aj.). Např. benzen působí chromosomální mutace a zlomy obou šroubovic DNA, takže nemůže dojít k jejich reparaci. Dehtové částečky se ukládají subepitheliálně, v plicním intersticiu apod., dlouhodobě pak na povrchu epithelu v době, kdy řasinky jsou poškozeny. Anorganické karcinogenní látky z kouře jsou – byť v malé koncentraci- šestimocný chrom, arsen, olovo, rtuť, nikl a kadmium v ionizované formě. Kancerogenita následkem kovů je hlavně způsobena produkcí ROS. Ovšem ani vyšší koncentrace kovů nemusí způsobit vznik karcinomu, nejsou-li přítomny dehtové látky. Plocha povrchu plic činí cca 70 m2, ale např. aromatické uhlohydráty se mohou koncentrovat v určitých oblastech, takže schopnost opravy může lokálně chybět. Inhalované kovy nelze degradovat a jsou ukládány na různá místa plicní tkáně. Některé kovy jako zinek, měď, železo a vápník participují v důležitých buněčných aktivitách jako je kontrola genové transkripce, vodivost nervů, příjem kyslíku, v některých enzymových funkcích, kontrole buněčné apoptózy apod. Některé toxické kovy mohou nahradit tyto prvky, následkem čehož jsou poškozeny vitálně důležité funkce. Dokonce v některých případech i biologicky užitečné kovy se mohou stát toxickými. Tak lokálně může vzniknout příznivá situace pro vznik nádoru. Plynná fáze cigaretového kouře obsahuje genotoxické komponenty a inhibitory opravy DNA. Toxické a kancerogenní látky v cigaretovém kouři jsou některé uhlohydráty (etylen, butadien, izopren aj.), aldehydy a ketony (acetaldehyd, akrolein, aceton aj.), nitrily a aminy (etylnitril, fenylamin aj.), aromatické uhlohydráty (benzen, toluen, styren aj.), heterocyklické sloučeniny obsahující kyslík (furany aj.) a další plynné i neorganické látky (oxid siřičitý, oxid uhelnatý, amoniak, kyanovodík aj.). Např. benzen působí chromosomální mutace a zlomy obou šroubovic DNA, takže nemůže dojít k jejich reparaci. Některé látky se stávají karcinogeny až při jejich metabolické přeměně v organismu, např. 1,3- butadien se mění na mutagenní a karcinogenní epoxidy. Dehtové částečky se ukládají subepitheliálně, v plicním intersticiu apod., dlouhodobě pak na povrchu epithelu v době, kdy řasinky jsou poškozeny. Anorganické karcinogenní látky z kouře jsou – byť v malé koncentraci- šestimocný chrom, arsen, olovo, rtuť, nikl a kadmium v ionizované formě. Kancerogenita následkem kovů je hlavně způsobena produkcí ROS. Ovšem ani vyšší koncentrace kovů nemusí způsobit vznik karcinomu, nejsou-li přítomny dehtové látky. Plocha povrchu plic činí cca 70 m2, ale např. aromatické uhlohydráty se mohou koncentrovat v určitých oblastech, takže schopnost opravy může lokálně chybět. Inhalované kovy nelze degradovat a jsou ukládány na různá místa plicní tkáně. Některé kovy jako zinek, měď, železo a vápník participují v důležitých buněčných aktivitách jako je kontrola genové transkripce, vodivost nervů, příjem kyslíku, v některých enzymových funkcích, kontrole buněčné apoptózy apod. Některé toxické kovy mohou nahradit tyto prvky, následkem čehož jsou poškozeny vitálně důležité funkce. Dokonce v některých případech i biologicky užitečné kovy se mohou stát toxickými. Šestimocný chrom ve formě chromanu snadno proniká buněčnými membránami, asi skrz iontové kanály. Má mutagenní, genotoxické a karcinogenní účinek Kadmium patří mezi velmi toxické látky v cigaretovém kouři. jeho karcinogenní účinek má vztah k produkci ROS. Hladina kadmia v tukové tkání je cca 4x vyšší než u nekuřáků (10ng/g), v plicní tkáni cca 3x vyšší. Poločas setrvání kadmia v lidských plicích je delší než 9 let. Nikl je další složkou tabáku, který ho absorbuje z půdy. Nikl váže histony a působí oxidační poškození DNA. Kouření a endotelová dysfunkce Kouření způsobuje endotelovou dysfunkci poškozením tvorby NO a zvýšením oxidačního stresu. Pro funkci endotelu a monocytů je důležitý vaskulární endoteliální růstový faktor (VEGF-A). Stimulace migrace monocytů účinkem VEGF-A byla snížena u kuřáků, zlepšení nastává suplementací vitaminem C. Kouření snižuje hladinu vitaminu C, který je sice více extracelulárním antioxidantem, ale jeho nedostatek je provázen nízkou hladinou glutathionu v lymfocytech. Vlivem cigaretového kouře stoupá průměrný arteriální tlak a klesá elasticita koronárních arterií. Exposice nikotinu působí zvýšenou produkci volných radikálů, Vliv kouření na fertilitu Spermatozoa produkují ROS, které podporují narušení povrchu vajíčka při oplodnění. Kouření výrazně zvyšuje množství ROS a vede ke zvýšené lipoperoxidaci ve varlatech. Hladina malondialdehydu v nich stoupá o téměř 50%, klesá GSH a GPx, je poškozena tkáň varlat a dochází i k abnormální spermatogenezi. Kouření zvyšuje až o 48% vzestup seminárních leukocytů a 107% vzestup ROS. Seminární plazma má normálně vysokou antioxidační kapacitu, aby membrány spermatozoí nebyly poškozovány lipoperoxidací, lipoperoxidace je totiž okamžitě usmrcuje. Nikotin a oxidační stres se považují za významné teratogenní faktory v těhotenství. Relativně častá je otevřená neurální trubice, v deformovaných strukturách je veliká apoptóza, zvláště v přítomnosti vysoké intracelulární hladiny vápníku. Jako jedné z příčin předčasného odtoku plodové vody se uvádí i kouření. Zánět nebo infekce produkují kyselinu chlornou, která poškodí amnion a chorion, resp. kolagen I. Podání vitaminů C a E může toto poškození tkáně snížit.
Gynekologie a porodnictví
Preeklampsie
Synonyma: Těhotenská toxikóza, pozdní gestóza, (Edémy, Proteinurie, Hypertenze). Hlavním mechanismem je generalizovaná vazokonstrikce, která způsobí přesun vody do tkání a zvýší hematokrit. Na tento stav dehydratace reaguje organismus hemodynamicky redistribucí objemu, která je dána aktivací sympatiku. Laboratorně bývá přítomna proteinurie. Hodnotí se semikvantitativně jako + až +++, obvykle jedná se o hodnoty nad 300 mg/den. Dále kyselina močová, která vzniká vlivem nadbytku kyslíkových radikálů. Narůstající ischemií stoupá podíl enzymu xantinoxidázy, čímž stoupá i urát (vzestup urátů nad 320 μmol/l je marker vzniku preeklampsie). Také stanovujeme malondialdehyd (MDA) (produkt peroxidace lipidů, nový marker).
Početí ve vyšším věku – nebereme-li v úvahu jiné faktory - by teoreticky mohlo prodloužit průměrný věk, protože by byly zdůrazněny geny vhodné pro delší dožívání.
Porod
Porod je provázen vznikem oxidačního stresu, zvláště ve vypuzovací fázi. Navíc novorozenec ještě nemá vyvinutý antioxidační systém, kompenzuje to zvýšenou produkcí bilirubinu. Možná tekutý molekulární vodík by mohl snížit novorozeneckou hyperbilirubinemii. Množství redukovaného a oxidovaného glutathionu je u porodů statisticky významně vyšší. Suplementace selenem v organické formě, může snížit oxidační stres v šestinedělí. Dávky selenu zvyšují aktivitu antioxidačních enzymů glutathion peroxidázy a superoxiddismutázy.
Ovariální kmenové buňky byly nedávno poznány jako buňky, které mohou dát vznik oocytům v kultuře a dokážou produkovat zdravé oocyty in vivo. Tato práce může zvrátit dogma, že žena se narodí se stovkami vajíček, které jsou časem ztraceny poškozením a genomovou nestabilitou. My jsme ze zkušenosti získané studiem stárnutí a metabolismu poznali, jak ženská infertilita může být odložena nebo zvrácena. Našim cílem je identifikovat geny a malé molekuly, které mohou reaktivovat ovariální kmenové buňky in vivo a tak léčit předčasné poškození ovariální funkce, chemoterapeutické poškození (u pacientek s karcinomem) a prodloužit zdravou a plodnou periodu žen.
Stomatologie
Plomby- podporují Fentonovu reakci
Progresivní periodontitis: nahromaděné leukocyty - ↑volné radikály, kyselina chlorná, KoQ10 - ↑ krvácení a uvolňování zubů
Zubní caries- drcení potravy, exogenní příjem volných radikálů
STÁRNUTÍ
Donedávna jsme považovali stáří za přirozený a nezvratný proces, ale stáří a stárnutí je nemoc, kterou je třeba léčit. Ačkoliv kyslík je nutný k životu, jeho vysoká koncentrace je pro buňky zvláště v plicích nebezpečná a tyto musí být chráněny antioxidanty.
Stárnutí. de facto začíná od porodu dítěte. Později projevy stárnutí probíhají několika pochody:
- Stárnutí funkční
Sem patří funkce poznávací, fyzické, nálady a duševní zdraví. Projevuje se především zhoršením koordinace, zmenšující se slovní zásobou, depresí, únavou, ztrátou autonomie, smutkem, nízkou plodností, poruchami spánku, zmenšující se slovní zásobou, sníženou mobilitou, zmatkem, chybnými rozhodnutími, špatnou výkonností, poruchou smyslů, křehkost a vyčerpáním.
- Stárnutí fenotypické
Sem se zařazuje fenotypické stárnutí (fenotypy se mění), složení těla, energetika, mechanismus homeostázy a zdraví mozku. Projevuje se nemocemi ledvin, degenerací chrupavek, záněty, špatnou kvalitou svalů, energetickou nedostatečností, degenerací chrupavek, ztrátou chuti, imunosenescencí, nízkou NCV (nerve conduction velocity), vysokou nukleární magnetickou rezonancí, osteoporózou, sarkopenií, nízkou zdatností, rezistencí na insulin, arteriální tuhostí, sníženým srdečním výdejem a dysautonomií.
- Stárnutí biologické
Sem se zařazují poškození molekul, poruchy jejich oprav, enegetické vyčerpání a redukce signálů/hluku. Projevuje se epigenetickými poruchami, buněčnou senescencí, vyčerpáním kmenových buněk, ztrátou proteostázy, genomovou nestabilitou, deregulací nutričního vnímání, zkrácením telomérů a změnou mezibuněčné komunikace.
Stárnutí je multifaktoriální proces a proto je mnoho teorií stárnutí Mezi nejlépe odpovídají současnému stavu jsou dvě:
- 1) Telomérová teorie
Teloméry (teloméry se po dělení zkracují a tedy během stárnutí se zkracuje jejich délka, která je asi limitována geneticky (Teorie podobná hořící svíčce). Enzym telomeráza prodlužuje zkrácený konec teloméru po buněčném dělení a tak umožňuje buňkám neomezené rozmnožování. Většina lidských buněk však telomerázu nemá, protože se dělí málo, takže ji nepotřebuje na rozdíl od kmenových buněk. S každým dělením buňky se u nového chromozomu tvoří nová telomera, která je s každým dělením o něco kratší, až se dostane do stavu, kdy je velmi krátká. Buňka sama pozná, že se dostala na onu kritickou mez délky telomery a většinou zastaví své dělení tím, že sama sebe zničí.
- 2) Volně radikálová teorie
Volné radikály oxidačně poškozují lipoproteiny, bílkoviny, nukleové kyseliny a další látky. Volné radikály jsou zneškodňovány především antioxidanty. Hromadění poškozených molekul a nedostatečná rychlost jejich opravy urychlují stárnutí a podporuje vznik chorob závislých na věku, chorob onkologických, neurodegenerativních aj.
Volné radikály poškodí denně asi 10 00x DNA v každé jedné buňce. Organismus poškození opravuje, ale neopravená se sčítají a při dalším dělení se fixují, pokud nedojde k smrti buňky.
Po určité době vstupuje buňka do stavu senescence, kdy ztrácí schopnost proliferace. Ve stáří selhává eliminace senescentních buněk imunitním systémem, což může porušit funkci tkání a způsobit vznik nádorů. Tyto senescentní čili stařecké buňky organismus vyčerpávají. Ve stáří selhává eliminace senescentních buněk imunitním systémem. Tyto senescentní čili stařecké buňky organismus vyčerpávají. Pořád berou živiny, potřebují kyslík, ale nic důležitého neprodukují. K senolytickým prostředkům se používá Pycnogenol, desatanil s quercetinem. Velmi efektivní v zabíjení senescentních buně je: dasantibid, používaný k léčení některých leukemií a blokující enzym, který reguluje přežívání buněk a zabíjející jen senescentní mesenchymální buňky. Fisetin se nemá podávat s antivitaminy K. Je to antioxidační flavonoid, který zabíjí senescentní buňky a působí i preventivně protinádorově. K senoterapeutikům, které zabíjí senescentní buňky a působí preventivně protinádorově patří i pterostilben, navitoclax a L-theanin ze zeleného čaje (zklidňuje organismus). Pokud buňky ve stadiu senescence ve velké množství zahynou najednou mohou rozlít svůj intracelulární obsah do okolní tkáně a způsobit orgánovou dysfunkci. Starší lidé nejsou schopni tento odpad odstranit. Možnost podávat senolytické léky pomáhá zdravým lidem oddálit pokles fyzických sil a nemocí. Kvalita života je v čem by senolytika mohla pomoci: ukazuje se, že by stačilo jen třeba píchnout je do kloubů, aby se člověku, který má těžkou artrózu kolenou, ulevilo a klouby se omladily.
Jak stárnou naše buňky:
Neopravená DNA (neustálé ohrožení znečištěním, oprava není vždy úspěšná, vady se hromadí- nádorové bujení)
Chyby regulace DNA (vlákna DNA jsou ovinuta kolem shluků proteinů zvaných histony. Geny se zapínají nebo vypínají podle toho, kde se metylové skupiny navážou k DNA a histonům. Jsou-li tato připojen vadná, může být ohrožena přesná koordinace genové aktivity)
Poškození chromosomálních čepiček (DNA má zvláštní koncové čepičky, které se podobají koncům tkaniček do bot. Říkáme jim teloméry. S věkem se zkracují a degenerují. Chromosomy se potom začnou rozpadat- to způsobí smrt buněk v životně důležitých orgánech).
Vadné proteiny (jsou-li poškozené skládají se nesprávně a mají tendenci shlukovat se a zanášet buněčný aparát způsobem, který může vyvolat Alzheimerovu či Parkinsonovu chorobu).
Deregulovaná odezva na živiny (nadbytek potravy může překročit schopnost mitochondrií ho zpracovat a dochází k poškození).
Mitochondiální dysfunkce (mitochondrie přeměňují potravu v energii. Vytváří více než 90% buněčné energie a téměř všechny volné radikály.) Vytváření zombie buněk (stárnutím se přestanou dělit (senescence), ale mohou tvořit molekuly, které poškodí sousední buňky. Avšak mohou hrát nějakou roli při hojení ran.
Ztráta funkčnosti kmenových buněk (schopnost opravit poškozené tkáně závisí na zdravých kmenových buňkách. Ty vytváří nové buňky, ale jejich produkce ve stáří klesá a tím se snižuje schopnost organismu obnovit poškozené tkáně a buňky.)
Chybná komunikace mezi buňkami (komunikace je zprostředkována především hormony, poškození může vyvolat stálý zánět).
Osm rad pro delší život
1) Cvičit nebo být jinak fyzicky aktivní. Riziko brzké smrti se snižuje o 45 procent.
2) Neužívat opioidy. Riziko se snižuje o 38 procent.
3) Nekouřit. Riziko se snižuje o 29 procent.
4) Nevystavovat se stresu. Riziko se snižuje o 22 procent.
5) Jíst zdravě a pravidelně. Riziko se snižuje o 21 procent.
6) Nepít příliš mnoho alkoholu. Riziko se snižuje o 19 procent.
7) Dobře se vyspat. Riziko se snižuje o 18 procent.
8) Mít pozitivní sociální vztahy. Zvyšuje dlouhověkost o 5 procent.
Stáří a délka života jsou ovlivňovány řadou faktorů, z nichž uvádíme:
tloušťku karotické intimy a médie a poměr ku celkové antioxidační kapacitě (TAC) / hydroperoxid (HPX): viscerální tukovou tkáň, nutriční faktory (polynenasycené mastné kyseliny, trans- mastné kyseliny, Fe, vitamin C a příjem karotenoidů, kofein, příjem alkoholů, historii kouření, fyzickou aktivitu, depresi (stres a úzkost), kvalitu spánku a riziko apnoe. Navíc je vztah k markerům zánětu, CRP a IL-1β. Stárnutí samo o sobě je spojeno s poklesem antioxidační obrany, se zkracováním telomérů, s imunosenescencí a mitochondriální dysfunkcí. Jedním z prvních nervů, které stárnutí zasáhne je nerv zrakový (nervus opticus).
Delší věk rypošů, dlouhověcí žraloci, mořské řasy aktivují SIRT 6, napomáhají opravám DNA a posilují genovou stabilitu.
Restrikce potravin: Má to svou logiku: zpracování látek z potravy zaměstnává mitochondrie, což je špinavý provoz, protože vzniká spousta odpadních produktů, volných kyslíkových radikálů, které jsou schopné poškozovat buněčné membrány, ale i DNA.
Studium mitochondrií došlo v posledních letech k renezanci. Sledování ukázalo, že běžné stářím působené nemoci mají složku mitochondriální. Nyní, což je překvapivě málo známo o progresivní ztrátě mitochondriální schopností během stárnutí. Prokazujeme, že buněčný mechanismus může být použit udržení mitochondriální homeostázy a konečně prodloužit délku života.
Látky, které mohou ovlivnit stárnutí:
MUDr. Levi-Montalcini získala Nobelovu cenu za objev bílkoviny, nazývané nervový růstový faktor (ang. NGF). Od jeho objevení byly o NGF provedeny stovky studií. Tyto studie ukázaly, že NGF má mnoho výhod:
Eliminuje ztrátu paměti a pokles kognitivních funkcí spojených se stárnutím. Pomáhá při přežití a udržení mozkových buněk.️ Chrání a napravuje poškozené mozkové buňky. Zabraňuje tomu, aby se mozek s přibývajícím věkem zmenšoval, což prokázala magnetická rezonance. Nejúčinější látkou je ginkgo biloba, která zvýšila hladinu NGFa podporovala zdraví mozku.
Ženšen má blahodárné antioxidační a protizánětlivé vlastnosti a může pomoci zlepšit mozkové funkce, jako je paměť a nálada. Některé studie prokázaly, že výtažky ženšenu inhibují zánět a zvyšují antioxidační kapacitu buněk. Jedna ze studií sledovala 30 zdravých lidí, kteří po dobu čtyř týdnů každodenně užívali výtažek ženšenu. Na konci studie se u osob ukázalo zlepšení duševního zdraví, sociálního fungování a nálady. Další studie ukázala, že denní užívání výtažku ženšenu zlepšilo matematické dovednosti a osoby více zklidnilo.
Metformin může snižovat počet neurodegerativních onemocnění a malignit.
Kopřiva obsahuje histamin, acetylcholin a serotonin, dále četné flavonoidy, v kořenu jsou četné minerály. Serotonin zlepšuje náladu, působí proti depresím. Acetylcholin podporuje paměť, kognitivní funkce. Má tedy i antioxidační účinek.
Karnosin: omlazuje stárnoucí buňky, prodlužuje životnost buněk, má antioxidační obranu, podporuje syntézu kolagenu, má pozitivní vliv na paměť, buduje svalovou hmoty a energii a zlepšuje toleranci zátěže
Melatonin působí aktivaci SIRT3.
Rapamycin
Antidiabetika akarbóza a metformin pomáhají zlepšit fyzickou aktivitu myší.
Xenolytika
Zelený čaj + pepř
Koenzym Q10 při sledování lidí starších 90 let byli výrazně mentálně schopnější ti, kteří měli v krvi vyšší hladinu koenzymu Q-10, který chrání mozkové buňky. Stárnutím hladina KoQ10 klesá nejdříve v srdci. Nedostatek KoQ10 oslabuje imunitní systém, klesá tvorba T-lymfocytů.
Kukurmin snižuje zánět, chrání klouby, podporuje srdeční činnost a imunitní systém.
Ostropestřec podporuje regeneraci buněk.
Mořské řasy jsou zdrojem vlákniny, polynenasycených mastných kyselin, vitaminů, minerálů aj.
Ve stáří selhává eliminace senescentních buněk imunitním systémem, což může porušit funkci tkání a způsobit vznik nádorů. Možnost podávat senolytické léky pomáhá zdravým lidem oddálit pokles fyzických sil a nemocí.
Objev dlouhověkých genů ukázal, že je možné značně zpomalit tempo stárnutí.
Sirtuiny jsou původně popsané jako NAD+ závisé deacetylázy histonů a tlumiče kvasnic. Mají nyní mnohem více funkcí a jsou hojnější v živém organismu. Členové rodiny sirtuinů deacetyláz podporují dlouhověkost a mnozí různí živočichové si mohou prodloužit život, jsou-li regulovány. Sirtuiny jsou klíčové regulátory mnoha buněčných funkcí včetně růstu buněk, apoptózy, metabolismu a genetické kontroly nemocí závislých na věku. Sirtuiny byly nalezeny téměř u všech skupin živých organismů, a to včetně kvasinek, i některých virů. Rostliny vystavené stresu (například suchu) brání nepřízni osudu syntézou polyfenolických látek a následnou mobilizací genů pro sirtuiny a přenášejí polyfenolový signál i na býložravce, kteří je konzumují.
Na sirtuiny je třeba se podívat z historického hlediska. Určitě nevznikly bez příčiny. V historii byl často nedostatek potravy. Její nadbytek vznikl až v posledním století (proto lidský organismus nemá dost účinné prostředky k zábraně obezit.
Obesita
Potenciálmí příčiny rezistence na leptin zahrnují zánět, zvýšení volné mastné kyseliny a vysoké hladiny leptinu. Všechny tyto 3 markery jsou u obezity zvýšené.
Leptin udržuje tukovou rovnováhu organismu a je produkován tukovými buňkami.
Tvorba leptinu :
• tvorba leptinu je primárně regulována změnami
vyvolanými inzulínem v metabolismu adipocytů
• příjem tuku a fruktózy nezvyšuje sekreci insulinu
tato forma úhrady energie zv. příjem energie
a zv. přírůstek hmotnosti
• nedostatečná produkce leptinu neplodnost
Jaký je rozdíl mezi leptinem a ghrelinem?
Druhý hormon nazývaný ghrelin, má na starost zvýšení chuti k jídlu. Jedná se o peptidový hormon, který je produkován ghrelinergními buňkami, které komunikují s mozkem. Hladina grehlinu je před jídlem vyšší a po jídle klesá. Je produkován v žaludku a kolísá po celý den v závislosti na příjmu potravy. Jakmile se v žaludku vytvoří, stoupající hladina ghrelinu vysílá do mozku signál, který u nás vyvolá pocit hladu. Je považován za jediný hormon stimulující chuť k jídlu u lidí a je také jedním z hlavních faktorů, který u lidí způsobuje záchvatovité přejídání. Více ghrelinu se uvolňuje přímo v reakci na stres, což vysvětluje, proč má tolik lidí tendenci jíst, když jsou ve stresu. Tím přispívá k přibírání na váze. Tady vidíme, že i když mají oba hormony jinou funkci, musí spolupracovat na tom, aby nastolili rovnováhu a dokázali regulovat pocity hladu a sytosti.
Jak na leptinovou rezistenci?
Je potřeba zmínit, že hladina leptinu není jediné kritérium, které stojí za obezitou. Mezi další ovlivňující faktory patří také inzulínová rezistence, díky které tělo ukládá více tuku, celkový způsob stravování, genetika, věk, pohlaví, množství fyzické aktivity i zdraví střev. Ovšem je několik režimových opatření, která můžete udělat sami jen s trochou úsilí. Hladinu leptinu lze především ovládat správným výběrem potravin s dostatkem vlákniny, cvičením, dostatečným spánkem a snížením stresu.
Zařaďte přerušovaný půst
Nejčastější forma přerušovaného půstu je 16/8. Jak už sám název napovídá, jde o to, že 16 hodin se postíte a 8 hodin je časové okno, kdy se najíte. V praxi to znamená například vynechávání snídaně. Půst započne například večeří (cca v 19 hod) a může končit třeba v poledne druhého dne. Důvodů, proč začít s prerušovaným půstem je několik.
Leptinová rezistence je v podstatě nerovnováha mezi leptinem a ghrelinem. Aby tyto hormony mohly spolupracovat, musí mít k tomu dobré podmínky. To je i důvod proč z dlouhodobého hlediska nefungují diety s výrazným omezením energetického příjmu. Tyto dva hormony se totiž nedají jen tak oklamat a nejen, že se zpomalí rychlost metabolismu, ale znamená to také snížení funkce štítné žlázy a ukládání tuků.
1) Odpočívejte a snažte se mít stres pod kontrolou
Chronický stres, který zažíváme, je považován nejen za nebezpečný, protože se tím zvyšuje riziko srdečních chorob, cukrovky, duševních poruch a autoimunitních onemocnění - ale je také spojen s nárůstem tuku a špatnými stravovacími návyky. Se stresem se pojí také dostatek odpočinku a spánek. Spánek pomáhá regulovat stresové hormony a pokud máte dostatek kvalitního spánku, máte pod kontrolou i chuť k jídlu. Tím snížíte i míru
2) Emoční stravování je způsob stravování, kdy si člověk kompenzuje jídlem prožitý stres nebo jiný druh emoční nestability. Ve chvíli takového stravování se nejedná o fyziologický hlad, ale je právě jeho opakem. Dochází k záchvatovitému přejídání a v průběhu času i obezitě. Pokud procházíte stresovým obdobím, dávejte pozor na to, zda nejíte z emocionálních důvodů.
3) Zařaďte pohyb alespoň na 30 minut denně
Cvičení je jedním z nejlepších způsobů, jak budovat svalovou hmotu, urychlit metabolismus a zvýšit citlivost na leptin (podobně jako zvyšuje citlivost na inzulín). Pokud máme pravidelný pohyb, zvyšuje i rychlost metabolismu a schopnost regulovat leptin. Stačí když pohybu věnujete 30-60 minut denně. Třeba v podobě rychlé procházky, běhu nebo HIITU. HIIT je intervalový trénink s vysokou intenzitou kombinuje krátké, vysoce intenzivní cvičení s pomalejšími fázemi, opakovanými během jednoho krátkého 15–20 minutového intervalu. Provádí se při 85–100% maximální tepové frekvence člověka. Zpočátku vám mohou připadat takové tréninky příliš náročné. Ať už se rozhodnete pro HIIT trénink, nebo pro jakýkoli jiný druh pohybu, vždy to bude krok dopředu, za který vám tělo poděkuje. Každopádně při výběru pohybové aktivity zohledňujte i svou kondici. Pokud bude pohybová aktivita nad vaše síly a nebude proložena odpočinkem, sníží se hladina leptinu a obvykle zvýší i chuť k jídlu.
4)Dejte přednost čerstvým potravinám
Náš mozek nerozlišuje jen jídlo jako takové, ale velkou roli v tomto hraje chuť jídla. Pokud dáváme přednost kalorickým a vysoce zpracovaným potravinám, způsobuje to změny v mozku, které dále zvyšují chuť k jídlu. To je důvod, proč je konzumace čerstvých potravin považována za tak důležitou pro regulaci chuti k jídlu.
5) Jezte pomalu
Nejezte, když jste rozptýleni nebo vykonáváte více činností. Zpomalte a jídlo důkladně rozžvýkejte. Pokud možno vyhýbejte se jezení u televize, počítače nebo telefonu. Ideální řešení je sednout si v místnosti, kde nemáte žádné rušivé elementy.
Námořníci, kteří ztroskotali na moři přechází na jedno jídlo denně. Medvěd v zimě spí, proto méně ztrácí na váze. Jíst hodně vlákniny, ta snižuje vstřebávání glukózy.
Impulzy do mozku, aby byla chuť na sladké dávají střevní bakterie. Když 3-4 týdny jíme stravu bez glukózy, tak si ty bakterie zvyknou na nízkou glukózu a až ji tak nevyžadují a člověk snadno překoná mlsnotu. O těch impulzech svědčí následující pozorování. Venkovské ženy, kde ta hygiena nebývá na prvním místě, mívají pozitivní protilátky proti toxoplazmóze na rozdíl od městských žen. Je prý prokázáno, že toxoplazmóza ovlivňuje mozek a snad všichni odvážlivci mají pozitivní protilátky proti toxoplazmóze, která snižují pocit nebezpečí. Po zhubnutí je třeba s mírnými odchylkami dodržovat dietu stále. Problém této diety spočívá v tom, že miliony lidí není schopno ji dodržet.
Zasahovat do střevního mikrobionu je asi riskantní, ale zničení stávající flory antibiotiky a následná kolonizace střev florou od pacientů, jejichž mikrobion je adaptován na nízkou hladinu glukózy, či selektivní odstranění flory podporující oxidační stres je asi utopická představa.
Impulzy do mozku, aby byla chuť na sladké dávají střevní bakterie. Když 3-4 týdny jíme stravu bez glukózy, tak si ty bakterie zvyknou na nízkou glukózu a až ji tak nevyžadují a člověk snadno překoná mlsnotu. Ona i vnuk to dělají a jsou štíhlí na rozdíl ode mne. O těch impulzech svědčí následující pozorování. Venkovské ženy, kde ta hygiena nebývá na prvním místě, mívají pozitivní protilátky proti toxoplazmóze na rozdíl od městských žen. Je prý prokázáno, že toxoplazmóza ovlivňuje mozek a snad všichni odvážlivci mají pozitivní toxoplazmózu (protilátky), která snižuje pocit nebezpečí. Po zhubnutí je třeba s mírnými odchylkami dodržovat dietu stále. Problém této diety podle mne spočívá v tom, že miliony lidí není schopno ji dodržet.
Zasahovat do střevního mikrobionu je asi riskantní, ale zničení stávající flory antibiotiky a následná kolonizace střev florou od pacientů, jejichž mikrobion je adaptován na nízkou hladinu glukózy, či selektivní odstranění flory podporující oxidační stres je asi utopická představa.
V poslední době se osvědčují na hubnutí dosud málo dostupné léky Ozempic a Saxenda.
Nádory
Jednou z příčin vzniku nádorů jsou nepochybně volné radikály. Mohou mutovat DNA, podporovat účinek kancerogenů, bránit přirozené apoptóze, ale na druhé straně i pomoci léčit již vzniklé nádory (rtg ozáření, radioterapie, cytostatika (např. cis-platina, adriamycin aj.). Význam antioxidantů v nádorovém bujení je nepochybný. Antioxidanty mohou chránit před vznikem nádorů, ale už u vzniklého nádoru mohou naopak chránit nádor.
Vznik nádorů probíhá v několika fázích.


Invazivní fáze znamená obvykle genové změny. Zvyšuje se aktivita některých proteáz, které jako hydroxyurea usnadňují nádorové metastázy krevní nebo lymfatickou cestou.
VZNIK NÁDORU:
Nadorovy genotyp začiná změnami v chromosomech a přechazí postupně do nádorového onemocnění. Nadorový genotyp je výsledek nahromadění mutací (alterace) genu pro řízeni proliferace, diferenciace a zániku (apoptózy) buněk. Příkladem mutace je např. oxidace adeninu volným hydroxylovým radikálem, kdy –NH2 skupina je nahrazena skupinou –OH. Pak adenin se místo na thymin váže na cytosin, čímž dochazí k mutaci. Podobně oxidací guaninu vzniká vazba na adenin místo na cytosin.
Volné radikály vzhledem k nádorovému onemocnění jeví dvojí funkci. V prvé fázi volné radikály mutují DNA (RNA). Některé z mutací mohou vést k nádorovému zvrhnutí. Ve druhé fázi nádorové buňky mají schopnost prioritně z prostředí absorbovat antioxidanty k vlastní ochraně a naopak málo vstřebávat polynenasycené mastné kyseliny (PUFA), které snadno podléhají lipoperoxidaci volnými radikály a tím způsobit smrt buňky.
Antioxidanty naopak v prvé fázi působí preventivně proti vzniku nádorových buněk, v druhé fázi pak chrání nádorové buňky před terapií volnými radikály (ozařováním, radioaktivitou, cytostatiky, které účinkují formou volných radikálů (cisplatina, adriamycin), škodlivinami v prostředí, NK buňkami apod.
Nádorový fenotyp pak znamená maligní transformaci buňky. Projeví se ztrátou kontroly proliferace, přítomností telomerázy, která umí prodlužovat teloméry („nesmrtelnost buňky“), poruchou buněčné signalizace účinkem ROS, antiapoptózou, ztrátou kontaktu buňka-buňka, invazivitou, alterací metabolizmu a podporou angiogeneze. Nádorové buňky vznikají poruchou diferenciace i poruchou apoptózy. Nádorové buňky mohou tak vzniknout z normálních buněk, ale i z kmenových buněk, které mají potenciál sebeobnovy a jsou mnohem závažnější pro vznik rezistence na terapii a vznik recidivy. Antioxidanty – dárci elektronu a prooxidanty – akceptory elektronu - reagují podle redox stavu. p53 je specifický transkripční faktor a supresorový gen proti nádorům, který je nejčastěji mutován u lidských karcinomů.
Karcinomem iniciovaná buňka ze zdravé buňky vzniká náhle během jednoho nebo více dní, její přeměna na preneoblastickou buňku však trvá mnohdy 10 i více let. I další přeměna na neoblastickou buňku trvá rok a více, ovšem vznik klinického nádoru pak je již otázkou doby kratší než 1 rok. Samozřejmě doba do vzniku nádoru se může případ od případu značně lišit. Všechny tyto přeměny jsou podporovány volnými radikály a ROS látkami, naopak antioxidanty tento pochod mohou významně zpomalit. Určitou výjimku činí selen, který sice nádorová buňka přednostně vstřebává, ale reakcí selenu v buňce s glutathionem dochází k těžkému poškození a smrti nádorové buňky. Udává se, že podávání 300 µg selenu denně je prevencí před vznikem karcinomu. Ovšem bezpečná dávka selenu je 250 µg/den, takže je třeba pacienta kontrolovat. Selen podporuje apoptózu u kultivovaných nádorových buněk. Bylo i prokázáno, že rostliny bohaté na selen (např. česnek) mají ochranný účinek před karcinomem.

Invazivní fáze karcinomu znamená obvykle genové změny. Zvyšuje se syntéza některých proteáz, keré podobně jako hydroxyurea, usnadňují nádorové metastázy krevní nebo lymfatickou cestou.
Po agresivní terapii cytostatiky smrt velkého množství buněk působí vznik množství volných radikálů,které znemožňují podáváním ještě vyšších dávek léků, aby nedošlo k smrti pacienta. Antioxidanty v těchto případech by mohly umožnit podávat zvýšit dávky léků.
V nádorové tkáni bývá snížená kataláza, celková antioxidační kapacita, kyselina askorbová, zvýšený cholesterol, lipoperoxidace a porušena rovnováha mezti štěpením a zábranou štěpení bílkovin.
Nádor může dosáhnout bez angiogeneze jen velikosti 1 mm3. Normálně existuje rovnováha mezi aktivátory a inhibitory angiogeneze. Převaha aktivátorů a hypoxie podporuje růst nádorů. Hypoxie však současně nádorové buňky poškozuje, stoupá množství odpadových látek, které jsou transportovány do lymfy, tím se zvyšuje osmotický tlak a vzniká prostředí, kam pronikání léků je obtížné. Úspěšné ozařování vyžaduje vznik volných radikálů, které poškodí DNA tumoru a způsobí jeho apoptózu.
Děti matek trpících v těhotenství nedostatkem vitaminu C častěji onemocní mozkovým nádorem.