Milada Teplá
KUDCH, PřF UK v Praze
email: milada.tepla@natur.cuni.cz
Biochemie - mezioborová témata
- NA: Slovo úvodem
- NA: Studijní text
- NA: Animace
- Trávení: Slovo úvodem
- Trávení: Studijní text
- Trávení: Animace a videa
- Digestion: English version
- Dýchání: Slovo úvodem
- Dýchání: Studijní text
- Dýchání: Animace a videa
- Lipidy: Slovo úvodem
- Lipidy: Studijní text
- Lipidy: Animace a videa
- Signalizace: Slovo úvodem
- Signalizace: Studijní text
- Signalizace: Animace
- Sport: Slovo úvodem
- Sport: Studijní text
- Sport: Výukové materiály
- Volné radikály a Antioxidanty
Nukleové kyseliny, replikace, transkripce, translace a genové inženýrství
Trávicí soustava, trávení přírodních látek
Dýchací soustava, transport kyslíku a oxidu uhličitého a buněčné dýchání (dýchací řetězec a syntéza ATP)
Lipidy, biologické membrány a transport látek přes membrány
Buněčná signalizace
Biochemie a sport
Biochemie v lékařství
Nukleové kyseliny - studijní text
Studijní text slouží jako studijní podklad pro bližší seznámení, vysvětlení a pochopení principů a pochodů, které jsou znázorněny ve výukových animacích tematicky zaměřených na nukleové kyseliny. Text může sloužit jak žákům při samostudiu, tak učitelům při přípravách na vyučovací hodiny. Materiál je členěný na 17 podkapitol, které odpovídají 17 dílčím animacím. Obsahuje mmj. schémata, obrázky a vzorce, které doplňují textové informace a poznatky uvedené v animacích. Některé informace uvedené v textu se v různých podkapitolách opakují. Toto je záměrné, jelikož se předpokládá, že práce s textem bude probíhat na základě zhlédnutých animací (tedy po zhlédnutí jedné animace se mohou informace doplnit z příslušné kapitoly studijního textu).
Některé odstavce jsou psány menším písmem, jedná se o doplňky, které mohou sloužit pro zájemce o rozšíření znalostí v dané problematice.
Studijní text zde ke stažení: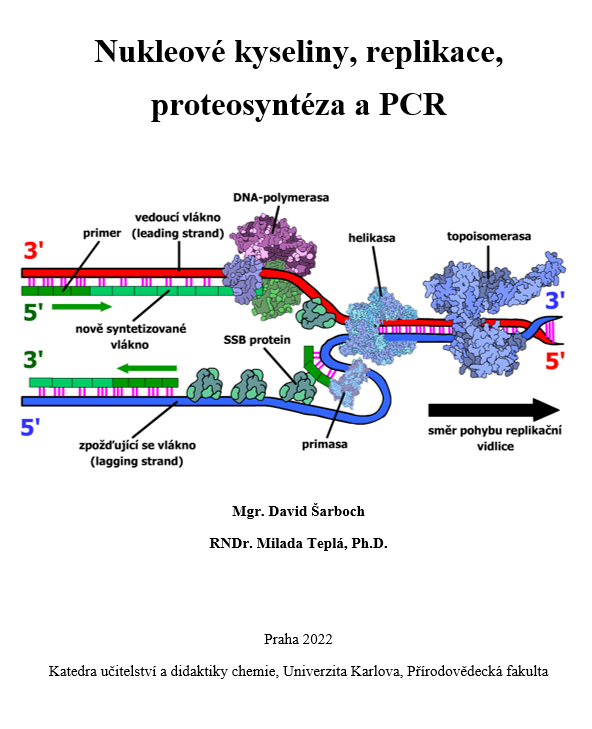
Živočišná buňka
Buňka je základní stavební a funkční jednotkou každého organismu. Z hlediska struktury můžeme rozdělovat buňky prokaryotické (bakterie) a eukaryotické (Eukarya – živočichové, rostliny, houby, prvoci, …). Tak jako se lidské tělo skládá z orgánů, které jsou tvořeny různými buněčnými (tkáňovými) typy a mají svou specifickou funkci, tak se i každá buňka skládá z různých oddílů (organel), které mají různý tvar a plní různé funkce. Většina buněčných organel obsahuje na svém povrchu fosfolipidovou membránu. Na Obr. 1 je souhrn nejdůležitějších a nejběžnějších organel živočišné buňky.
Obr. 1 – Organely živočišné buňky.
Endoplasmatické retikulum
Jednou z membránových organel buňky je endoplasmatické retikulum (ER). Dělíme jej na drsné ER (rER = rough endoplasmic reticulum), které na svém povrchu nese ribosomy, a hladké ER (sER = smooth endoplasmic reticulum) bez ribosomů. Membrána endoplasmatického retikula navazuje na vnější membránu jadernou. Celá organela sestává ze vzájemně propojených plochých dutin, měchýřků a trubic. Na rER probíhá biosyntéza proteinů, které jsou určeny pro membrány, lysosomy, buněčný export apod. (ostatní proteiny vznikají v cytoplasmě na volných ribosomech nevázaných na ER). Takto vytvořené proteiny se zabalené do váčků (vznikajícími odškrcením membrány rER) transportují do Golgiho aparátu.
Oproti tomu hladké endoplasmatické retikulum (sER) žádné ribosomy neobsahuje. V jeho kanálcích probíhá biotransformace xenobiotik (pro tělo cizorodých látek) a některé metabolické dráhy lipidů (syntéza fosfolipidů, částečně i cholesterolu, steroidních hormonů). sER je také úložištěm vápenatých iontů. Ve svalových buňkách se vyskytuje specializovaná forma sER, tzv. sarkoplasmatické retikulum, které je zásobárnou Ca2+ pro svalový stah.
Golgiho aparát
Golgiho aparát je další membránovou organelou buňky tvořenou tzv. „cisternami“ vrstvícími se nad sebou do sloupců (bráno ze směru od jádra). Zde dochází ke zrání proteinů (např. glykosylace, tedy připojování cukerných zbytků), jejich třídění a sbalování. Odtud jsou pak váčky s proteiny posílány do dalších koutů buňky (na lysosomy, cytoplasmatickou membránu apod.).
Mitochondrie
Mitochondrie jsou organely velikosti bakterie (několik mikrometrů). Tento rozměr není náhodný, nejpřijímanější současná teorie vzniku této organely mluví o tzv. endosymbióze, tedy o pozření bakteriální buňky (konkr. α-proteobakterie) předkem dnešní eukaryotické buňky (tuto teorii dokládá fakt, že mitochondrie obsahuje zbytky vlastní aktivní DNA a ribosomy). Dávný eukaryot si tuto bakterii „ochočil“ a v současné době jsou mitochondrie nejen v lidských buňkách centry katabolických a oxidativně fosforylačních reakcí.
Ve prospěch endosymbiotické teorie svědčí i přítomnost dvou membrán, z nichž ta vnitřní je přisuzována původní bakterii (neobsahuje např. žádný cholesterol, což je pro prokaryotické membrány běžné), zatímco ta vnější se svým složením nápadně podobá eukaryotickým membránám.
Mitochondrie se vyskytují ve velkém počtu (až 2000) téměř ve všech eukaryotních buňkách. Uvnitř těchto organel dochází ke vzniku adenosintrifosfátu neboli ATP (díky procesu oxidační fosforylace na komplexu ATP-synthasy), syntéze hemoglobinu, ke Krebsově cyklu a β-oxidaci mastných kyselin. Také část močovinového cyklu je lokalizována uvnitř mitochondrie.
Cytoplasmatická membrána
Buněčná (cytoplasmatická) membrána polopropustně odděluje vnitřek buňky od jejího okolí. Polopropustnost znamená, že některé molekuly (např. malé polární či malé i velké nepolární) dokážou membránou samovolně procházet. Na druhou stranu větší polární molekuly a ionty potřebují pro transport specifické přenašeče či kanály. Tato vlastnost vyplývá ze struktury membrány jako takové. Skládá se z dvojvrstvy fosfolipidů, u kterých má každá molekula dvě části: polární a nepolární (říkáme, že daný lipid je amfifilní). Fosfolipidy směřují polárními částmi ven a dovnitř buňky, nepolárními částmi jsou přimknuty k sobě. Toto semknutí je způsobeno ve výsledku docela slabými hydrofobními interakcemi a některými van der Waalsovými silami, proto se mohou proti sobě posunovat. Takto je zajištěna tzv. fluidita (tekutost) membrány. Kromě lipidů se v membráně nacházejí i proteiny plnící rozličné funkce (transport látek přes membránu, …). Na vnější straně membrány (ta směřující do extracelulárního prostoru) jsou na proteinech a lipidech mnohdy navázané také krátké oligosacharidové řetězce vytvářející tzv. glykokalyx, tedy jakýsi ochranný val proti narušení celistvosti membrány.
Brvy
Brvy, nebo také řasinky, se nacházejí na některých eukaryotických buňkách. Jsou to tenké vláskovité útvary směřující do extracelulárního prostoru. Některé konají pravidelný pohyb (řasinky dýchacího epitelu či ty, které pohybují vajíčkem ve vejcovodech), jiné mají smyslovou funkci (např. vnímání zvuků). Jsou tvořeny tubulinem a dalšími proteiny.
Centrosom
Dělící tělísko (centrosom) se během většiny fází buněčného cyklu skládá ze dvou válcovitých centriol a je organizačním centrem mikrotubul – buněčného lešení, po kterém se např. transportují váčky s obsahem určeným k vypuštění z buňky. V této organele jsou mikrotubuly ukotveny a větví se do celé buňky. Ve většině buněk se centrosom nachází blízko jádra, u řasinkových buněk se ale přibližuje k brvám a tvoří jejich tělíska, ze kterých brvy vyrůstají (viz Obr. 1 ).
Cytoplasma
Cytoplasma je tekutinou vyplněný prostor ohraničený buněčnou membránou. Jedná se o ústřední reakční prostor buňky, kde se uskutečňují mnohé metabolické dráhy (translace, glykolýza, biosyntéza mastných kyselin, část močovinového cyklu, …). Obsahuje také rozpustné molekuly (cukry, proteiny, nukleové kyseliny, metabolity...), ionty a buněčné organely.
Jádro
Každá lidská buňka, kromě erytrocytů, obsahuje jádro. Jedná se o největší buněčnou organelu, jež navíc obsahuje genetickou informaci (jaderný genom; genom je soubor veškeré genetické informace organismu, tedy i mimojaderné) v podobě DNA, která je buď kopírována v rámci replikace nebo přepisována do molekul RNA. Buněčné jádro je vyplněno nukleoplasmou, která obsahuje téměř veškerou DNA buňky. Jaderná DNA vytváří společně s histony (na kterých je vlákno DNA navinuté) a dalšími strukturními proteiny chromatin, který během dělení buňky kondenzuje v chromosomy. V mnoha jádrech lze pozorovat oblast zvanou jadérko, jehož DNA obsahuje mnoho kopií genů pro více typů molekul rRNA. Jádro je od cytoplasmy odděleno vnitřní a vnější jadernou membránou, která v určitých místech přechází do membrány drsného endoplasmatického retikula. Z toho důvodu jsou i na vnější jaderné membráně přítomny ribosomy.
Lysosomy
Lysosomy jsou organely rozmanitého tvaru obalené jednoduchou membránou. V jednotlivé buňce je přítomno několik set lysosomů. Slouží jako "buněčné žaludky" – váčky, ve kterých dochází k hydrolytickému štěpení všech makromolekul. Toto štěpení je katalyzováno zhruba 40 různými hydrolasami (lipasy, sacharasy, nukleasy, proteasy, …), které mají aktivní optimum v prostředí s pH kolem 5. Díky aktivní práci protonových pump se uvnitř lysosomů hromadí H+ (vodíkové kationty), tedy se tam neustále za spotřeby ATP udržuje optimální hodnota pH. Při neutrálním pH (jako např. v cytoplasmě) je aktivita lysosomálních enzymů silně snížena, což může působit jako ochranný mechanismus před samonatrávením buňky v případě, že by enzymy pronikly do cytoplasmy.
Buněčné jádro – úvod
Buněčné jádro je největší organela eukaryotických buněk, ve které je uložena podstatná část buněčné DNA (jen asi 1 % DNA se nachází v mitochondriích). Kromě DNA se v jádře nacházejí různé typy RNA a bílkovin, které mají enzymatickou a strukturní funkci. Jaderná DNA vytváří společně s histony a dalšími strukturními proteiny tzv. chromatin. Celá hmota chromatinu je rozkouskována na několik kratších úseků, tzv. chromosomů. Ty jsou buď rozvolněné (euchromatin), nebo zkondenzované do typických tvarů písmen "X, Y" (heterochromatin). V průběhu dělení buňky chromatin kondenzuje na chromozomy, přechodně zaniká také jaderná membrána. Během interfáze (období mezi dvěma buněčnými děleními) lze v určité oblasti jádra rozeznat nahuštěný chromatin, kterému se říká jadérko. To se vytváří z genů zejména pro rRNA (ribosomální RNA). Na rozdíl od rRNA se např. mRNA a tRNA transkribují z rozvolněnější chromatinové oblasti. Po vzniku mRNA se tato musí ještě různými způsoby modifikovat – přidávají se další nukleotidy a vyštěpují se nepotřebné části ribonukleotidového řetězce (více v podkapitole „Zrání mRNA“). V jádře vytvořené molekuly RNA určené pro syntézu bílkovin mohou být transportovány do cytoplasmy až po ukončení těchto procesů.
Kromě syntézy RNA pomocí transkripce je dalším významnou funkcí jádra i replikace DNA (zdvojení mateřské DNA), ke které dochází před buněčným dělením.
V jádře také vzniká velmi důležitý koenzym oxidoreduktas (tedy enzymů katalyzujících oxidačně-redukční pochody v celé buňce), NAD+ (nikotinamidadenindinukleotid).
Buněčné jádro – membrána
Jádro je obaleno dvěma fosfolipidovými membránami. Vnitřní je vyztužena proteinovou sítí, tzv. jadernou laminou. V té jsou zakotveny různé jaderné struktury, mmj. i chromatin. Vnější jaderná membrána přechází v určitých místech ve váčky endoplasmatického retikula. Tato organela zastává mnoho funkcí, podílí se mmj. na syntéze a úpravě proteinů, které vznikají na ribosomech. K propojení dějů, které se odehrávají v jádře a v cytoplasmě, slouží jaderné póry (viz Obr. 2). Těmi mohou procházet molekuly RNA a proteiny (stavební i enzymy) oběma směry. Takto je zajištěna alespoň částečná kontrola transportovaných molekul.
Obr. 2 – Schéma výřezu jaderné membrány.
Vnější membrána přechází v membránu hrubého endoplasmatického retikula. Vzhledem k tomuto vztahu i jaderná membrána nese na svém povrchu ribosomy, které syntetizují do mezimembránového prostoru proteiny.
Perinukleární (mezimembránový) prostor je ohraničen oběma vrstvami jaderné membrány, dále přechází ve vnitřek (lumen) hrubého endoplasmatického retikula. I do perinukleárního prostoru jsou díky ribosomům syntetizovány proteiny.
Přecházení molekul ve směru z jádra do cytoplasmy a naopak umožňují složité komplexy jaderných pórů. Tento děj je selektivní a regulovaný, navíc závislý na spotřebě energie (GTP). Jaderné póry jsou tvořeny četnými proteiny (nukleoporiny), vytvářejícími spolu kruhovité, na sebe navazující struktury. Nízkomolekulární látky (včetně malých proteinů) procházejí jadernými póry bez obtíží. Větší molekuly (mRNA, proteinové ribosomální podjednotky, …) neprojdou, pokud nenesou jadernou lokalizační sekvenci (např. sled specifických aminokyselin, upravené dusíkaté báze apod.).
Vnitřní vrstva membrány pomáhá stabilizovat genetickou informaci (chromatin) v jádře tím, že na sebe váže proteiny nazývané jaderné laminy. Ty mají dvě funkce, jednak vytváří vnitřní oporu pro celý jaderný obal, jednak na sebe vážou samotný chromatin, v čemž výrazně pomáhá např. protein emerin. Jedná se o transmembránový protein, který zprostředkovává spojení mezi fosfolipidovou membránou a proteinovou sítí jaderných lamin (tvořených intermediárními filamenty).
Nukleové kyseliny – nukleotidy
Každá buňka se skládá z několika základních biomolekul. Mezi ty hlavní patří: sacharidy, lipidy, proteiny a nukleové kyseliny. V souřasné době rozeznáváme dva hlavní typy nukleových kyselin (RNA a DNA).
Nukleové kyseliny (RNA i DNA) jsou lineární polymery tvořené daným pořadím (primární strukturou) stavebních jednotek. Těmito jednotkami jsou nukleotidy (nucleus = jádro) skládající se vždy ze tří složek.
Základ každého nukleotidu tvoří pětiuhlíkatý monosacharid β-D-ribosa v případě ribonukleové kyseliny (ribonucleic acid, RNA) a nebo její derivát β-D-2-deoxy-ribosa v případě deoxyribonukleové kyseliny (deoxyribonucleic acid, DNA) – viz Obr. 6. Monosacharid ribosa patří mezi pentosy a v nukleotidech se vyskytuje pouze v cyklické formě (β-D-ribofuranosa). Na druhém uhlíku nese hydroxylovou skupinu (viz Obr. 3). To přispívá k menší stabilitě molekul RNA (viz dále).
Obr. 3 – Kuličkové modely a strukturní vzorce ribosy a 2-deoxyribosy.
Oproti tomu deoxyribosa má C2 volný, resp. obsazený dvěma atomy vodíku, což zodpovídá za vyšší stabilitu vláken DNA (oproti vláknům RNA). Oba monosacharidy nesou na C1 navázanou dusíkatou bázi.
Druhou složkou obou typů nukleových kyselin jsou zbytky kyseliny fosforečné (resp. kyseliny trihydrogenfosforečné), fosfátové skupiny, které propojují pentosy dvou nukleotidů (přes uhlíky 3´ a 5´ monosacharidu). Střídající se fosfátové skupiny a monosacharidové jednotky tvoří pentosa-fosfátovou páteř. Pentosa-fosfátová páteř je negativně nabitá, jelikož při pH, které se za fyziologických podmínek vyskytuje v buňce (průměrné pH cytoplasmy buněk je 7,0-7,3), jsou fosfátové skupiny plně disociované (H+ ionty z jejich hydroxyskupin jsou odštěpené a navázané na molekuly vody za vzniku H3O+ iontů).
Záporný náboj fosfátů neslouží jen k tomu, aby vytvořil negativně nabitý povrch pentosa-fosfátové dráhy (čehož se pak využívá při nekovalentní vazbě DNA na histony). V molekulách NDP a NTP (nukleosiddifosfátů a nukleosidtrifosfátů, viz dále) jsou záporně nabité fosfáty bezprostředně navázané vedle sebe díky odpudivým silám zdrojem potřebné energie pro průběh mnoha chemických reakcí v organismech.
Třetí složkou nukleotidu je nukleová dusíkatá báze (viz Obr. 4 ). Ta má z hlediska informačního rozhodující funkci, jelikož zprostředkovává kontakt např. s protilehlým vláknem v molekule DNA (viz dále komplementarita). Dusíkaté báze jsou z chemického hlediska deriváty dvou heterocyklických sloučenin (obsahujících v cyklu jiný atom než C), které mají slabě zásaditý charakter. Tou první je molekula purinu tvořená dvěma kondenzovanými aromatickými kruhy. Druhou dusíkatou bází vyskytující se v nukleotidech je molekula pyrimidinu. Jedná se o monoheterocyklickou sloučeninu. Obě dvě molekuly jsou planární (rovinné), díky systému konjugovaných dvojných vazeb. Tento fakt přispívá k finální struktuře dvouvláknových DNA a RNA – dusíkaté báze se mohou bez obtíží „schodovitě“ rovnat nad sebe a vytvořit finální strukturu. Od těchto dvou heterocyklických sloučenin jsou dále odvozené jejich deriváty vyskytující se v samotných molekulách nukleových kyselin.
Adenin (A), derivát purinu, nese na svém C6 aminoskupinu. Kromě toho, že se vyskytuje v nukleových kyselinách, je také součástí molekul ATP (adenosintrifosfát), jež poskytují energeticky náročným reakcím dostatek energie pro jejich uskutečnění.
Guanin (G) je druhou purinovou bází. Kromě aminoskupiny na C2 nese také oxoskupinu na C6. Je alternativou ATP v některých biochemických reakcích. Zároveň jako GMP (guanosinmonofosfát) se účastní buněčných signálních kaskád.
Od pyrimidinu jsou odvozeny celkem 3 dusíkaté báze. Tou první je cytosin (C). Nese aminoskupinu na C4 a oxoskupinu na C2. Kromě jeho role v nukleových kyselinách je CTP důležitým aktérem při fosforylaci např. fosfolipidů.
Thymin (T) je dusíkatou bází vyskytující se pouze v molekulách DNA. Jeho součástí jsou dvě oxoskupiny na C2 a C6. Na rozdíl od všech ostatních nukleotidů obsahuje navázanou methylovou skupinu na C5. Tvoří náhradu za uracil vyskytující se v RNA.
Uracil (U) je třetí heterocyklickou pyrimidinovou bází. Obsahuje dvě oxoskupiny na C2 a C6. Až na methylovou skupinu se jedná o stejnou molekulu jako thymin. Uracil se vyskytuje pouze v RNA, v DNA je nahrazen právě thyminem.
Obr. 4 – Kuličkové modely a strukturní vzorce purinu a pyrimidinu a z nich odvozených dusíkatých bází.
V případě vzniku N-glykosidové vazby mezi C1 (deoxy)ribosou a bází (dusík N9 purinu či dusík N1 pyrimidinu) vznikne NUKLEOSID (adenosin, guanosin, cytidin, uridin, thymidin). V momentě, kdy se na některou z volných hydroxylových skupin (deoxy)ribosy naváže fosfát (jeden až tři zbytky kys. fosforečné), vzniká NUKLEOTID (Obr. 5 ).
Názvy takto vzniklých nukleotidů jsou odvozeny od názvů příslušných nukleosidů, tedy např. cytidin‑5´‑monofosfát (CMP), adenosin-5´-difosfát (ADP) či deoxyguanosin-5´-trifosfát (dGTP).
Obr. 5 – Kuličkový model a strukturní vzorec molekuly ATP.
Přes hydroxyskupinu navázanou na C3 monosacharidu se může navázat další nukleotid. Mluvíme o tzv. 3'-konci nukleotidu, resp. polynukleotidového vlákna. Toto označení bude velmi důležité např. při replikaci či transkripci. Na C5 monosacharidu je naopak navěšen přes fosfoesterovou vazbu trifosfát – viz Obr. 5. Tento konec nukleotidu, resp. polynukleotidového řetězce, se značí jako 5'-konec, což bude opět důležité při metabolismu nukleových kyselin (viz Obr. 6).
Nukleové kyseliny – DNA
DNA je polymerní molekula sestavená z nukleotidů. Místo ribosy jsou zde obsaženy molekuly deoxyribosy (absence -OH skupiny na 2 C). Zároveň uracil je zde nahrazen thyminem. DNA také sestává ze dvou polydeoxyribonukleotidových řetezců.
Povrch celé molekuly je polární z důvodu přítomnosti cukerných a fosfátových zbytků její páteře. Fosfátové skupiny jsou při fyziologickém pH jádra dokonce ionizovány, tudíž je povrch celé dvoušroubovice záporně nabitý. To má i své strukturální opodstatnění – díky zápornému povrchu se může DNA dobře nekovalentně vázat na jaderné histony, bílkoviny, jejichž povrch je převážně kladně nabitý.
Jednotlivá vlákna DNA jsou spojena H-můstky mezi bázemi. Báze jsou navzájem komplementární (doplňkové), tedy např. adenin se páruje vždy pouze s thyminem (v RNA tedy s uracilem) přes 2 H-můstky, guanin s cytosinem se párují vždy pomocí 3 H-můstků. Donory H-můstků mohou být -NH2 skupiny či -NH- skupiny aromatických kruhů (viz Obr. 6). Akceptory jsou pak karbonylové kyslíkové atomy a dusíkové atomy heterocyklických kruhů. Polydeoxynukleotidové řetězce jsou v dvoušroubovici navzájem uspořádány antiparalelně (tzn. hlava k patě - jeden řetězec je ve směru 5'→3', druhý pak 3'→5'); na jednom konci dvoušroubovice je 5'-konec jednoho vlákna a 3'-konec vlákna druhého (určeno dle čísel atomů C v deoxyribose).
Ve výsledku můžeme shrnout, že za fyziologického stavu tvoří polovinu všech bází purin (A, G), druhou polovinu pak pyrimidin (T, C). Obsah A je roven obsahu T a totéž platí pro G a C. Tento fakt nazýváme po jeho objeviteli Chargaffovo pravidlo.
Obr. 6 – Znázornění párování bází v kuličkovém modelu DNA.
Aromatické báze jsou srovnány uvnitř dvoušroubovice přibližně v pravých úhlech k její ose. Centrální část dvoušroubovice je tedy nepolární. Sekundární struktura (helix) je udržována π-interakcemi, mezi jednotlivými patry bází, a H-můstky (viz dále). Za pozornost stojí i existence "žlábků", kdy zejména do velkého žlábku zasahují báze těmi heteroatomy či skupinami, které netvoří H-můstky mezi nimi (Obr. 7). Tyto struktury umožňují interakce s bílkovinami, jejichž úkolem je regulovat funkce DNA.
Obr. 7 - Kalotový model molekuly DNA s vyznačenými žlábky a pentlicový model se znázorněnými vodíkovými můstky.
Nukleové kyseliny – RNA
RNA je polymerní molekula sestavená z ribonukleotidů (jako sacharid je zde obsažena ribosa). Další odlišností od DNA je přítomnost uracilu (U; volný 5C) místo thyminu (T; na 5C je navázaná methylová skupina -CH3). Tedy komplementární bází k adeninu (A) je v RNA právě uracil. Tyto dvě báze se ale stejně jako v DNA (A=T) vážou přes 2 H-můstky.
Na rozdíl od DNA zaujímá RNA primárně jednovláknovou strukturu, nicméně i na ní může docházet ke komplementárnímu párování bází a tedy vzniku krátkých šroubovicových struktur (helixů).
Obr. 8 – Struktura 7-methyl-guanosinové čepičky na 5‘-konci mRNA.
Prvním významným typem RNA je mRNA (messenger, mediátorová, Obr. 9). Tato molekula vzniká transkripcí (přepisem) DNA v jádře a tedy slouží jako templát (předloha) pro syntézu proteinů na ribosomech. Její velikost je díky tomu velmi heterogenní a také doba života je velmi krátká – od desítek sekund u prokaryot po pár hodin, max. dní, u eukaryot. Díky omezené délce života je možné skrz mRNA regulovat syntézu proteinů. U eukaryot podléhají molekuly mRNA syntetizované transkripcí tzv. posttranskripčním modifikacím. Zaprvé je na 3'-konec vlákna připojen polyadenylátový ocas, sestávající z několika desítek adenylátových zbytků (nukleotidů dAMP). K 5'-konci je pak připojena tzv. 5'-čepička (methylovaný dGMP, viz Obr. 8). Obě tyto modifikace napomáhají transportu mRNA z jádra do cytosolu a chrání konce řetězců před hydrolytickým působením exonukleas (viz dále).
Obr. 9 – Zobrazení molekuly mRNA s provedenými posttranskripčními úpravami.
Druhou významnou skupinou RNA přítomných v buňce jsou tRNA (transferové), které v průměru tvoří cca 10-15 % z celkového obsahu RNA v buňce. tRNA se podílí na translaci mRNA do proteinového řetězce – přepisu mRNA do podoby proteinu. Její sekundární i terciární strukturu lze vidět na Obr. 10. tRNA je právě jednou z ribonukleových kyselin, která vytváří krátké šroubovice. Molekula tRNA obsahuje kolem 80 nukleotidů a v zásadě na její struktuře můžeme rozeznat dvě důležitá a funkčně rozdílná místa. Zaprvé to je antikodonová sekvence, díky které se tRNA váže na ribosomu (antikodon je triplet nukleotidů vážící se na kodon v mRNA) na kodonovou mRNA (ta obsahuje triplety nukleotidů, tzv. kodonů, odpovídajících vždy jednu aminokyselinu). Zadruhé zde nacházíme tzv. akceptorovou sekvenci, na kterou se váže jedna z 21 proteinogenních aminokyselin. Ta je díky tRNA přenesena na ribosom a začleněna do polypeptidového řetězce na základě komplementarity k mRNA (viz Translace).
tRNA obsahuje také některé méně běžné nukleotidy jako např. methylguanin, dimethylguanin a dihydrouracil (v Obr. 10 jsou znázorněné bílou a černou barvou).
Třetí významnou skupinou RNA molekul v buňce je tzv. rRNA (ribosomální). Tvoří spolu s proteiny nadmolekulovou strukturu ribosomů. Ribosomy jsou tvořeny dvěma podjednotkami – velkou a malou (Obr. 11). rRNA se podílí jednak na struktuře, jednak na katalytické funkci ribosomu při tzv. translaci; mRNA se váže mezi obě ribosomální podjednotky. Samotná sekundární (a tedy i terciární) struktura RNA je velmi komplikovaná.
Obr. 10 – Vyobrazení 2D a 3D struktury molekuly tRNA.
Všechny typy rRNA vytvářejí v ribosomu řetězce komplementárně propojené vodíkovými můstky a tvoří různé helikální úseky, střídané výdutěmi a zpětnými smyčkami.
Obr. 11 – Velká a malá ribosomální podjednotka. V odstínech modré jsou znázorněny proteinové struktury, v odstínech hnědé pak části nukleových kyseliny (rRNA).
Jak již bylo zmíněno, sacharidem přítomným v molekulách RNA je ribosa. Přítomnost -OH skupiny na C2 u ribosy přispívá k nestabilitě celé molekuly. Ta je způsobena přítomností parciálního kladného náboje na atomu P ve fosfátech a parciálního záporného náboje na atomu O v 2C-hydroxylových skupinách ribosy. Za určitých okolností (bazické prostředí, zvýšená teplota,…) může dojít k nukleofilnímu ataku atomu P ve fosfátu 2C-hydroxylovou skupinou, což ve výsledku vyústí v přerušení řetězce RNA a tedy rozpad celé molekuly – viz Obr. 12.
Obr. 12 – Mechanismus nukleofilního ataku atomu fosforu 2C-hydroxyskupinou.
Nukleové kyseliny – dogma molekulární biologie
Hlavním úkolem nukleových kyselin je zajistit uložení, předávání a realizaci genetické informace, která v sobě kóduje primární struktury bílkovin, tedy pořadí AMK. Informace o tomto pořadí jsou zapsány pomocí deoxyribonukleotidů v určitém úseku DNA zvaném gen.
Při biosyntéze bílkoviny (proteosyntéze) je gen nejprve procesem transkripce přepsán do krátké komplementární mRNA, která poté slouží jako mustr pro vlastní syntézu bílkovinového řetězce. Transkripce jaderné DNA probíhá v jádře buňky. Poslední fází tzv. genové exprese (syntézy aktivní bílkoviny na základě pořadí deoxyribonukleotidů) je translace (překlad). Při tomto procesu dochází na ribosomech k překladu gen. informace z "řeči" nukleotidů do "řeči" aminokyselin.
Realizace (exprese) genetické informace není ale jediným úkolem nukleových kyselin. Ty musí také předat gen. informaci z rodičů na potomky. K tomu slouží proces replikace, při kterém se zdvojí mateřské vlákno DNA před buněčných dělením.
Obr. 13 – Schéma popisující jednak centrální „dogma“ molekulární biologie (černě), červeně pak méně časté či alternativní možnosti (in vitro značí umělý, laboratorní průběh).
Centrální "dogma" molekulární genetiky obsahuje několik výjimek. První z nich je možný přepis RNA do DNA. Tento proces provádějí retroviry (např. HIV či virus hepatitidy B), které díky enzymu reverzní transkriptasa dokážou vytvořit DNA na základě vlastní molekuly RNA. Druhou výjimkou z "dogmatu" molekulární genetiky jsou části životních cyklů některých RNA-virů. Ty v hostitelské buňce indukují tvorbu nových RNA molekul na základě svého původního vlákna RNA. Nakonec je nutné zmínit, že in vitro jsou vědci schopni vytvořit protein pouze na základě molekuly DNA, tedy bez nutnosti syntézy mRNA. Vyvstává otázka, zdali je stále nutné znázornění procesu proteosyntézy považovat za „dogma“ molekulární genetiky. Všechny možné kombinace jsou shrnuty na Obr. 13.
Replikace – co je potřeba?
Základním substrátem pro replikaci je molekula jaderné (ale i mitochondriální či plastidové) DNA. V ní jsou pomocí nukleotidů kódované sekvence genů, které je potřeba při množení předat buňkám dceřinným. Replikace se účastní mnoho enzymů a replikačních faktorů. Jedním z těchto enzymů je topoisomerasa. Patří mezi isomerasy a specifickým mechanismem despiralizuje dvoušroubovicovou strukturu DNA uvolňováním hromadícího se torzního napětí.
Helikasa je enzym ze třídy hydrolas sloužící k rozdělování řetězců DNA. Mechanicky oddaluje protilehlé nukleotidy od sebe a tím přerušuje vodíkové můstky mezi nimi. Helikasa, stejně jako topoisomerasa, využívá také ke své práci molekuly ATP.
Než započne samotná replikace jednotlivých deoxyribonukleotidových vláken, musí nejprve enzym primasa (patřící do transferas) na začátek replikační vidlice nasyntetizovat krátký zhruba 5-10nukleotidový komplementární úsek RNA, tzv. primer, na který si poté nasedne hlavní replikační enzym DNA-polymerasa. Ta totiž neumí replikaci započít, potřebuje se napojit na volnou hydroxylovou skupinu C3. Krátký vytvořený primer tento volný hydroxyl DNA-polymerase poskytuje.
Transferasy, které přenáší nukleotidové stavební kameny při syntéze nukleových kyselin, se rozdělují podle různých kritérií. Zaprvé, záleží na tom, podle kterého vlákna již existující nukleové kyseliny se nové vlákno syntetizuje (např. pokud je „templátem“ vlákno DNA, je daná transferasa DNA-dependentní). Zadruhé je podstatné, kterou nukleovou kyselinu daná transferasa vytváří. Pokud např. při transkripci vzniká RNA (konkr. hnRNA, později mRNA), enzym katalyzující tuto syntézu se nazývá RNA-polymerasa. Tedy např. tranferasa syntetizující nové vlákno DNA při replikaci je DNA-dependentní-DNA-polymerasa, primasa by pak byla DNA‑dependentní-RNA-polymerasa. Zvláštním případem může být enzym reverzní transkriptasa, který využívají retroviry (viry obsahující RNA jako nukleovou kyselinu nesoucí genetickou informaci) v určité fázi svého životního cyklu. Protože se díky tomuto enzymu přepisuje virová RNA do DNA, enzym se nazývá RNA‑dependentní-DNA-polymerasa.
DNA-polymerasa (z třídy transferas) syntetizuje komplementární vlákna DNA z dostupných deoxyribonukleotidů. Základním mechanismem katalýzy je zprostředkování nukleofilního ataku hydroxylové skupiny na C3 rostoucího deoxyribonukleotidového řetězce na α-fosfát dNTP. Tento enzym je schopný svou práci také kontrolovat. V momentě zařazení špatného nukleotidu to DNA-polymerasa díky nevyhovující komplementaritě rozpozná a s pomocí obsažené exonukleasy daný nesprávně zařazený nukleotid odštěpí.
V momentě, kdy helikasa oddělí vlákna dvoušroubovice od sebe, mohly by v jádře přítomné endonukleasy takto "odhalenou" DNA štěpit. Rozpojená vlákna bv se také mohla opět spárovat. Tomuto brání tzv. ssb proteiny (single strand biding proteins), které nasedají na volná vlákna DNA a tím je chrání a izolují.
Při replikaci tzv. zpožďujícího se vlákna (lagging strand - viz "Průběh replikace") je potřeba spojovat nové úseky DNA (Okazakiho fragmenty). K tomuto procesu slouží enzym ligasa (patřící, kdo by to byl řekl, do třídy ligas), která za spotřeby ATP dva oddělené úseky kovalentně spojí pomocí fosfodiesterové vazby.
Kromě enzymů jsou k replikaci potřeba stavební kameny nových vláken DNA. Těmito kameny jsou deoxyribonukleotidy A, G, C a T. Ribonukleotidy jsou používány jen k syntéze primerů, následně jsou vyštěpeny a nahrazeny deoxyribonukleotidy. Výše uvedené molekuly a nadmolekulární struktury potřebné pro replikaci jsou znázorněny na Obr. 14.
Obr. 14 – Nejdůležitější molekuly a nadmolekulární struktury potřebné pro proces replikace.
Replikace – průběh
Část procesu replikace je znázorněna na Obr. 15. Replikace začíná na určitých místech DNA zvaných iniciační body a pokračuje odtud v obou směrech. Aby mohly být velké genomy replikovány přiměřeně rychle, obsahují více iniciačních bodů, na které mohou usedat enzymy katalyzující celý proces.
K replikaci je potřeba mnoho různých enzymů a replikačních faktorů. Jedním z enzymů nasedajících na iniciační bod je topoisomerasa. Ta v momentě, kdy už torzní pnutí zastavuje replikaci, despiralizuje dvoušroubovici DNA a uvolňuje torzní napětí vznikající rozplétáním molekuly.
I když jsou všechny replikační enzymy velmi často znázorňovány samostatně, ve skutečnosti se vytváří replikační komplex, ve kterém je většina enzymů a faktorů propojených.
Následně enzym helikasa rozděluje dvě vlákna DNA od sebe tím, že mechanicky obě vlákna oddaluje a tím trhá vodíkové můstky mezi bázemi. Rozrušováním vodíkových můstků a oddalováním vláken od sebe vzniká tzv. replikační vidlice. Je důležité si uvědomit, že replikace probíhá v obou směrech (a na více místech současně), replikační vidlice se tedy působením topoisomeras a helikas od sebe oddalují. Díky tomuto faktu se např. lidský genom v rámci jedné buňky replikuje "jen" několik hodin. Po rozvolnění vláken by mohlo docházet ke štěpení odhalených řetězců endonukleasami. Z tohoto důvodu se řetězce obalují ssb proteiny (single strand biding proteins), aby zabránily poškození vláken a jejich případnému opětovnému spojení.
Čtení DNA vláken probíhá vždy od 3' k 5' konci. Proto dochází ke kontinuální replikaci jen na jednom z obou řetězců, tzv. vedoucím řetězci (leading strand). U zpožďujícího se řetězce (lagging strand) je situace odlišná (viz dále).
Samotný proces syntézy nového vlákna začíná nasednutím primasy na volná vlákna DNA. Tento enzym syntetizuje primery. Čtení DNA probíhá vždy od 3' k 5' konci, tedy syntéza nového vlákna běží ve směru 5'→3' (důvod je vysvětlen v odstavci „Kontrola replikace“).
Po vzniku primerů nasedá na jejich C3 konec DNA-polymerasa, která pokračuje syntézou nových deoxyribonukleotidových vláken. DNA-polymerasa replikuje vedoucí vlákno kontinuálně, zaměřme se tedy nyní na vlákno zpožďující se. Protože syntéza nového řetězce může probíhat jen ve směru 5'→3' (jeho čtení ve směru 3'→5'), je replikace zpožďujícího se vlákna závislá na časté aktivitě primas. Replikace tohoto vlákna zaostává za tím vedoucím, odtud tedy plynou jejich názvy. Primasy musí vždy nasyntetizovat nový primer, na -OH skupinu C3 ribosy posledního ribonukleotidu následně nasedne DNA-polymerasa a vytvoří nový úsek DNA až k předchozímu primeru. Takto na zpožďujícím se vláknu vznikají samostatné, primery oddělené úseky nové DNA, které se nazývají Okazakiho fragmenty. Ribonukleotidové primery jsou později vystřiženy specifickým enzymem. Následně DNA‑polymerasa nahradí vzniklou mezeru deoxyribonukleotidy, aby zůstala zachována kontinuita nového vlákna.
Obr. 15 – Znázornění modelu replikační vidličky s nejdůležitějšími komponenty. Je potřeba zdůraznit, že většina enzymů je spojena do tzv. replikačního komplexu a nejsou odděleny tak, jako to je vidět na obrázku.
Nakonec je potřeba původní Okazakiho fragmenty (teď již bez primerů, naopak už s deoxynukleotidy) kovalentně spojit dohromady. Tento proces katalyzuje enzym ligasa, který vytváří chybějící fosfodiesterovou vazbu.
Je třeba si uvědomit, že všechny procesy replikace (rozvolňování vláken, syntéza Okazakiho fragmentů, ...) probíhají současně. Zároveň většina enzymů je spojena do jednoho replikačního komplexu pomocí různých enzymů, např. clamp (svorkových) proteinů.
Replikace – kontrola
Zatímco u bakterií, kde se replikuje i více než 1000 nukleotidů za sekundu, probíhá replikace u eukaryot mnohem pomaleji (asi 50 nukleotidů za sekundu). Tento rozdíl je dán zejména neustálou kontrolou správně zařazených nukleotidů, tedy správného párování bází. Tuto kontrolu provádí samotná DNA-polymerasa. Při průběhu replikace skenuje původní vlákno DNA a řadí jednotlivé nové nukleotidy dle jejich komplementarity k protilehlému vláknu, tedy: adenin (A) k thyminu (T) a cytosin (C) k guaninu (G).
Obr. 16 – Schéma mechanismu vystřižení nesprávně zařazeného nukleotidu a jeho náhrada. První řádek odpovídá správnému, reálnému nahrazení špatně inkorporovaného nukleotidu. Druhý řádek pak zobrazuje situaci, která neumožňuje špatně zařazený nukleotid nahradit správným, jelikož replikace mateřského vlákna proběhla ve špatném směru (3‘→5‘).
Syntéza nového vlákna probíhá ve směru 5'→3'. Důvodem je právě korekce replikace a případné exonukleasové vystřižení špatně zařazených bází. Kdyby totiž syntetizovala vlákno ve směru 3'→5' a potřebovala by vystřihnout špatně zařazený nukleotid, na 5' konci by již nebyly anhydridovou makroergní vazbou navázané fosfátové skupiny, a tak by chyběla energie pro polymerační krok. V případě, že se nové vlákno syntetizuje ve směru 5'-3', tak po odštěpení špatně zařazeného nukleotidu zůstává volný C3 hydroxyl, který může nukleofilně atakovat α-fosfát (1. fosfát) nového přicházejícího dNTP za odštěpení difosfátu (Obr. 16, obdobný nukleofilní atak je znázorněn na Obr. 12).
Během replikace vzniká mezi nukleotidy nového řetězce fosfodiesterová vazba za odštěpení difosfátu. Ten je následně rozštěpen na dva fosfáty a tím je rovnováha reakce posunuta směrem k produktům (a tedy reakce běží „jednodušeji“). V momentě, kdy se naváže nekomplementární nukleotid (vytvoří se vodíkové můstky mezi protilehlými bázemi), specifické místo na DNA-polymerase tuto chybu rozpozná. DNA-polymerasa následně hydrolyticky (za spotřeby molekuly vody) vystřihne špatně zařazený nukleotid (díky své exonukleasové aktivitě) a na jeho místo vloží nukleotid správný. Časté chyby při replikaci by vedly ke vzniku mutací, které jsou u bakteriálního genomu častější z důvodu absence korektorské aktivity bakteriální polymerasy.
Transkripce – průběh
Transkripce je biosyntéza RNA (konkrétně hnRNA), přičemž o pořadí ribonukleotidů ve vznikající jednořetězcové RNA rozhoduje pořadí deoxyribonukleotidů v příslušném genu.
Gen je část DNA, která kóduje většinou jeden konkrétní protein. V momentě, kdy buňka potřebuje tento protein použít, musí být gen přepsán z deoxyribonukleotidů do molekuly RNA a následně v průběhu translace převeden na finální bílkovinu. Každý eukaryotický ale i prokaryotický gen obsahuje tzv. promotor. To je oblast, kterou rozpoznává RNA-polymerasa, jež se po promotoru posouvá až k samotnému začátku kódující sekvence genu (Obr. 17).
Iniciace (začátek) transkripce je jedním z nejdůležitějších buněčných regulačních procesů. Oblast mezi promotorem a začátkem kódující sekvence je velmi významná; mohou se na ni vázat specifické molekuly, zejména proteiny, tzv. transkripční faktory (TF), které formují spolu s RNA-polymerasou výsledný transkripční komplex. Eukaryotické buňky jsou na formování transkripčního komplexu závislé, většina prokaryot žádné transkripční faktory nepotřebuje. TF mohou např. zablokovat RNA-polymerasu a tím pádem transkripci zamezit.
V momentě, kdy jsou přítomné všechny složky, RNA-polymerasa se začne posouvat po promotoru (který u eukaryot obvykle začíná tzv. TATA-boxem s typickou sekvencí T a A – díky tomu enzym rozezná začátek promotoru), dokud nenarazí na začátek kódující sekvence. Tu obvykle pozná díky tzv. START-kodonu, kterým je kodon pro methionin (AUG).
RNA-polymerasa následně skenuje kodující sekvenci, rozplétá ji a přiřazuje komplementární ribonukleotidy ke stávajícím deoxyribonukleotidům. Této fázi transkripce říkme elongace. Obě vlákna hned opět pojí k sobě. Na rozdíl od replikace je RNA-polymerasa jediným enzymem, který průběh elongace v procesu transkripce zajišťuje. Navíc, protože vznikající RNA není dlouhodobým nositelem gen. informace, není tak zásadní, aby při celém procesu nedocházelo k drobným chybám; proto RNA-polymerasa nemá opravnou funkci a elongační proces je ve srovnání s replikací o hodně rychlejší. Produktem transkripce je výsledná molekula hnRNA (heteronuclear RNA). Ta je tedy komplementární k původnímu vláknu DNA. Rozdíl je ve dvou strukturních prvcích: u hnRNA je deoxyribosa nahrazena ribosou a thymin je nahrazen uracilem.
V návaznosti na centrální „dogma“ molekulové genetiky bychom se mohli domnívat, že procesem transkripce vzniká pouze mRNA. Ovšem není tomu tak, tímto způsobem jsou syntetizovány i ostatní typy RNA.
Obr. 17 – Zjednodušené schéma procesu transkripce.
Transkripce – zrání mRNA
Molekula hnRNA (heteronuclear RNA) podléhá po transkripci několika zásadním modifikacím, které jí umožňují splnit její funkci. Těmto změnám se říká "zrání RNA". Jakmile jsou všechny změny dokončeny, vzniká mRNA schopná účastnit se translace.
Jednou ze změn je syntéza tzv. 5'-čepičky (na 5' konci molekuly, viz Obr. 8). Skládá se ze zbytku kyseliny trifosforečné a 7-methyl-guanosinu. Tato modifikace napomáhá transportu hnRNA z jádra do cytosolu a chrání její konec před působením exonukleas.
Druhou, u eukaryot velmi podstatnou modifikací, je připojení tzv. 3'-polyadenylátového konce (polyA-konec), který sestává z několika desítek adenylátových zbytků. Tato struktura opět brání degradaci molekuly a tím přispívá k její stálosti.
Dalším krokem při modifikacích molekuly hnRNA je sestřih, neboli splicing (Obr. 18). Geny eukaryot obsahují kódující sekvence = exony a nekódující sekvence = introny. Právě introny musí být před translací z hnRNA odstraněny, k čemuž slouží tzv. spliceosomy. Jsou to v jádře se nacházející ribonukleoproteinové komplexy, ve kterých má katalytickou funkci molekula RNA (tzv. snRNA = small nuclear RNA). Jejich úkolem je přesně a specificky vystřihnout nekódující sekvence.
Obr. 18. Vyobrazení procesu známého jako splicing. Na začátku je vidět molekula hnRNA obsahující introny (žlutě) i exony (modře), následně je připojena methylguanosinová čepička a polyadenylátový konec, dále na hnRNA nasedají spliceosomy, které vystřihují introny a tak vzniká výsledná mRNA.
Také ostatní typy buněčných RNA jsou posttranskripčně upravovány. rRNA je syntetizována jako jeden velmi dlouhý řetězec a pak je specifickými endonukleasami rozštěpena na několik typů molekul, které se stávají součástí nukleoproteinových komplexů ribosomů. Také tRNA je syntetizována jako prekursor, ze kterého je následně funkční forma vyštěpena. Mnohé báze jsou pak modifikovány (viz kapitola „RNA“).
Prokaryotické mRNA nepodléhají žádným modifikacím, proto je možné proces translace na 5'- konci započít už v době, kdy syntéza koncové 3'- části není ještě dokončena.
Translace – genetický kód a aktivace aminokyselin
K tvorbě proteinů je nutný překlad (translace) "z jazyka nukleových kyselin do řeči bílkovin." "Slovníkem" nutným k tomuto překladu je genetický kód. Ten je charakterizován čtyřmi atributy:
- je tripletový - každá AMK je popsána alespoň jedním tripletem (trojicí) nukleotidů. Pokud tedy potřebujeme do rostoucího polypeptidového řetězce zařadit novou AMK, velká ribosomální podjednotka přečte 3 po sobě jdoucí nukleotidy (kodon, např. CAU nebo CAC) na mRNA a dle nich zařadí příslušnou AMK.
- je degenerovaný - pro zabudování jedné AMK můžeme použít jeden, ale i více kodonů. Vzhledem k tomu, že se na mRNA vyskytují čtyři typy nukleotidů (A, U, G a C), které mají vytvořit triplety, je tedy celkový počet možných tripletů 43, tj. 64 trojic bází.
- je univerzální - platí (až na výjimky) stejná pravidla pro bakterie i všechny eukaryotní buňky. Jednou z výjimek je např. genetický kód mitochondrie, kde je např. tryptofan (Trp) kódován univerzálním STOP-kodonem UGA.
- nepřekrývá se – ve vláknu nukleové kyseliny je každý nukleotid součástí vždy jen jednoho tripletu.
Obr. 19 – Diagram zobrazující vztah mezi aminokyselinami a jejich tripletovými kodony. Fialově je vyznačena aminokyselina methionin, tmavě šedě pak STOP-kodony. V momentě, kdy bychom chtěli např. zjistit kodony pro AMK histidin, najdeme ji po obvodu diagramu. Následně od středu kruhu čteme písmena za sebou, tedy CAU nebo CAC.
Kodony, tedy triplety nukleotidů v mRNA (někdy se termín kodon používá i pro DNA), slouží tedy zejména k zařazení aminokyseliny do vznikajícího řetězce peptidu (viz Obr. 19). Některé kodony jsou ovšem určeny k jiným účelům. Pro terminaci translace jsou určené tzv. terminační, též STOP-kodony (UAA, UAG, UGA), které nekódují žádnou AMK, ale v momentě, kdy se objeví v A-místě translačního aparátu (viz Translace – průběh), jsou rozpoznány specifickými rozpustnými proteiny zvanými uvolňovací faktory, které po navázání ukončí celý proces translace. Naopak iniciační kodony (AUG) jsou signálem k zahájení translace a současně i kodonem pro methionin (viz Translace – průběh).
U replikace a transkripce vstupují stavební kameny nových vláken nukleových kyselin v aktivované formě jako (deoxy)nukleotidtrifosfáty. Nesou si tedy s sebou balíček energie v podobě anhydridové vazby mezi fosfáty, díky kterému je samotná polymerační reakce mnohem rychlejší. U translace, kdy se za sebou řadí jednotlivé aminokyseliny, je také potřeba danou AMK aktivovat ideálně ještě předtím, než vstoupí do translačního procesu. Tento proces aktivace je katalyzován enzymem aminoacyl-tRNA-ligasou patřící do třídy ligas. Nejprve se na karboxylovou skupinu aminokyseliny anhydridovou vazbou naváže AMP (uvolňuje se pyrofosfát), který je pak nahrazen příslušnou tRNA za vzniku esterové vazby (ta vzniká mezi karboxylovou skupinou AMK a volnou -OH skupinou ribosy na 3'-konci tRNA) (viz Obr. 20). Enzymy katalyzující aktivaci AMK jsou lokalizovány v cytosolu, nesouvisejí tedy s ribosomy a tím pádem mohou vytvářet aktivované AMK (aminoacyltRNA) do zásoby.
Obr. 20 – Schéma popisující aktivaci aminokyseliny (přenesení na tRNA) pomocí molekuly ATP.
Každému kodonu (na mRNA) odpovídá určitý antikodon (na tRNA). Tedy pro každý triplet kódující AMK existuje v buňce příslušná molekula tRNA. Proteiny lidského těla se skládají z 21 "proteinogenních-proteiny tvořících" aminokyselin (21. je selenocystein), které jsou v průběhu translace přinášeny navěšené na tRNA do vazebného místa ribosomu. Aminoacyl-tRNA-ligasy jsou velmi přísně substrátově specifické enzymy. Rozeznávají jak určitou aminokyselinu, tak i jí příslušnou tRNA tím, že pro ně mají vybudováné přesně "padnoucí" vazebné místo.
Translace – co je potřeba
Na rozdíl od jaderné replikace a transkripce, probíhá translace v cytoplasmě na nukleoproteinových komplexech - ribosomech, sestávajících ze dvou podjednotek. Ribosomy se mohou nacházet volně či na hrubém endoplasmatickém retikulu.
Prokaryotní a eukaryotní ribosomy se liší ve své struktuře. Tato odlišnost se stanovuje pomocí sedimentačního koeficientu Ten přímo souvisí s molekulovou hmotností dané látky a udává čas, za který proběhne v ultracentrifuze sedimentace ribosomu. Jednotkou je Svedberg (S), tato jednotka představuje čas 10−13 sekundy. Pak můžeme prokaryotický ribosom označit jako 70S, eukaryotický jako 80S.
mRNA vznikající transkripcí v jádře obsahuje na 5'-konci guanosinovou čepičku, která jí umožňuje navázat se na malou podjednotku ribosomu, a na 3'-konci pak polyadenylátový konec ochraňující vlákno mRNA před exonukleasami.
Obr. 21 – Některé molekuly a nadmolekulární struktury potřebné pro proces translace.
Molekula tRNA má několik důležitých úkolů. Zaprvé dopravuje příslušnou aminokyselinu na ribozom (ve formě tzv. aminoacyl-tRNA), zadruhé pak zprostředkovává kontakt s mRNA (díky antikodonu), tedy zodpovídá za navázání správné AMK na příslušný kodon. Výše popsané součásti procesu translace jsou zobrazené na Obr. 21.
Ribosom, mRNA a aminoacyl-tRNA nejsou zdaleka jediné struktury potřebné pro správný průběh translace. Té se dále účastní mnoho různých proteinů plnících regulační funkce. Jejich představení je ovšem nad rámec tohoto textu.
Translace – průběh
Translace patří k nejsložitějším buněčným procesům. Probíhá na ribosomech (nukleoproteinových komplexech), které působí jako katalyzátory. Ribosomy se nachází na hrubém endoplasmatickém retikulu nebo volně v cytoplasmě. Celý proces je zjednodušeně znázorněný na Obr. 22.
mRNA (se všemi posttranskripčními úpravami) se dostává z jádra do cytoplasmy skrz jaderné póry. Zde se váže na ribosomy přítomné na hrubém endoplasmatickém retikulu díky 5'-čepičce.
Každý ribosom je složen ze dvou nekovalentně spojených podjednotek - malé a velké. Do prostoru mezi nimi se váže mRNA (konkrétně primárně na malou podjednotku), která zde slouží jako templát pro translaci, tedy syntézu nového peptidu/proteinu. Kromě velké a malé podjednotky celý komplex obsahuje mnoho faktorů, proteinů, které jsou potřebné pro správný průběh translace (translační faktory) a dále tRNA nesoucí první aminokyselinu nového řetězce, kterou je vždy methionin (tRNAMet) s kodonem AUG (u bakterií je touto aminokyselinou N-formyl-methionin). Po navázání mRNA na malou podjednotku ribosomu začne tato skenovat mRNA až do momentu, kdy narazí na iniciační start kodon (AUG). Díky translačním faktorům se naváže velká podjednotka a tRNAMet se ocitne v jejím P-místě (peptidylové místo), viz Obr. 22. A-místo (aminoacylové místo) je volné a může se do něj podle volného kodonu na mRNA navázat další tRNA nesoucí příslušnou aminokyselinu. V momentě vazby takové tRNA (pomocí H-můstků) na mRNA vzniká peptidová vazba a to přenosem peptidylového zbytku, doposud vázaného esterovou vazbou na tRNAMet na volnou aminoskupinu aminokyseliny v A-místě. Reakce je katalyzována peptidyltransferasou, která je součástí nadmolekulové struktury ribosomu. Vznikl tedy dipeptid a nyní se musí obnovit původní stav. Molekula tRNA, z níž byl přesunut peptidylový zbytek, mění svou konformaci, ztrácí afinitu k P-místu a disociuje od ribosomu do cytoplasmy, čímž se P-místo uvolní. Do něj se přesune peptidyl-tRNA a současně se přesunuje i mRNA o jeden kodon (triplet) ve směru 5'→3'. Tento přesun vyžaduje přítomnost elongačního faktoru a hydrolýzu molekuly GTP.
Tímto způsobem pokračuje elongační fáze translace. Celý proces proteosyntézy je velmi energeticky náročný. Uvádí se, že rostoucí bakteriální buňky využívají 90 % energie získávané katabolickými procesy právě pro translaci.
Obr. 22 – Znázornění procesu translace.
Elongační fáze končí v momentě, kdy ribosom dospěje k sekvenci stop kodonu (UAA, UAG nebo UGA), který se dostane do A-místa. V buňce obvykle neexistují tRNA schopné navázat se na STOP kodon. Translace se proto zastaví a a na vzniklý komplex se může navázat jeden z terminačních (uvolňovacích) faktorů. Jsou to proteiny schopné rozložit celý komplex. Dochází tedy k oddálení obou ribosomálních podjednotek, oddisociuje mRNA i peptidyl-tRNA, z níž je pak ještě nutno hydrolyticky odštěpit vzniklý polypeptidový řetězec (bílkovinu).
Translace – modifikace
Při translaci vzniká polypeptidový řetězec, který je ovšem potřeba dále upravit a vytvořit tak funkční protein. Těmto úpravám říkáme posttranslační modifikace (Obr. 23 a 24). Jedná se o úpravy chemické struktury povětšinou enzymaticky řízené.
K častým úpravám patří zkracování polypeptidového řetězce. Základem je hydrolýza methioninu na N-konci, který je první aminokyselinou v molekule. K vyštěpování určité části proteinu může docházet i v cílové tkáni. Příkladem je např. enzym pepsin, který se do žaludečního lumen vylučuje v podobě neaktivní formy pepsinogenu a teprve po kontaktu s kyselým pH žaludku dochází k odštěpení krátkého peptidu kryjícího aktivní místo tohoto enzymu. Tehdy se z neaktivního pepsinogenu stává aktivní pepsin štěpící bílkoviny.
Tento princip aktivace pomocí odštěpení některé části z proteinu (většinou z N-konce) je základem tzv. krevní koagulační kaskády. V momentě, kdy je porušená celistvost krevního řečiště, je potřeba rychle v daném místě vytvořit sraženinu, která ránu ucpe a zabrání vykrvácení. K tomuto slouží kaskáda několika na sebe navazujících reakcí, kdy se neaktivní forma enzymu (často proteasy) mění na aktivní (např. změna neaktivního prothrombinu na aktivní thrombin) a tím ve výsledku dochází k agregaci proteinu fibrinu, který ránu ucpe.
Při enzymově řízené dehydrogenaci dochází k oxidaci thio skupin aminokyselin cysteinu a vzniku disulfidových můstků, které kovalentně pojí různé části řetězce dohromady a podílí se tak na vzniku terciární struktury proteinu.
Další modifikací (zejména u transportních proteinů či enzymů) je připojení iontů kovů (Cu2+, Zn2+, …) do struktury polypeptidu. Ty se do řetězce vmezeřují díky koordinačně-kovalentní vazbě a např. u metaloenzymů se často přímo podílí na jejich katalytické funkci.
Obr. 23 – Zde jsou vidět některé posttranslační modifikace proteinů (vystřižení methioninu, vytvoření disulfidových můstků a koordinace iontu kovu – znázorněn šedivou kuličkou).
Mezi další modifikace patří např. fosforylace proteinů. Ta je jedním z hlavních mechanismů regulace enzymatické aktivity (fosforylovaný enzym je aktivní, nefosforylovaný katalytickou funkci nevyvolává; je potřeba podotknout, že u některých enzymů platí toto pravidlo obráceně). Mezi typicky fosforylované proteiny řadíme např. již výše zmíněný pepsin. Dále se některé aminokyseliny proteinu mohou hydroxylovat (zejména kolageny), mohou na ně být navěšeny mono- či oligosacharidy (tím vznikají glykoproteiny), lipidové složky (vznik lipoproteinů) apod.
Většina bílkovin má během své syntézy (či po svém vzniku) tendenci shlukovat se např. nepolárními částmi svých řetězců dohromady a tím tvořit dále nevyužitelné shluky (agregáty). Naopak u nesbalených proteinů může docházet ke štěpení řetězců (endo-, exo-) proteasami. Jako ochrana před nechtěnou agregací či štěpením slouží tzv. chaperony, kulovité proteiny vážící se na peptidový řetězec a stabilizujícího do doby, než se ten zformuje do výsledného tvaru. Další možností poskládání proteinu do finální struktury nabízí soudečkovitý proteinový útvar chaperonin (Obr. 24). Ten do svého nitra pojme nesbalený protein a sledem konformačních změn je následně za spotřeby ATP vytvořen nativní (funkční) protein, jež je vypuzen ze soudku ven.
Obr. 24 – Chaperoniny a jejich mechanismus skládání proteinu do finální struktury. Do dutinky chaperoninu se vmezeří nesložený protein (společně např. s ionty kovů), obr. 1). Chaperonin je následně uzavřen a postupných stahováním a roztahováním soudku je protein formován do výsledného tvaru (obr. 2)). Na konci procesu se chaperonin otevře na druhé straně a vypustí složený protein do cytoplasmy (obr. 3)).
Finální struktura proteinů je tedy dána mnoha různými modifikacemi. Primární struktura proteinů je určena pomocí pořadí aminokyselin v polypeptidovém řetězci. Za vznik sekundární struktury (α-helixů a β-sheetů) zodpovídají H-můstky. Na finálním sbalení těchto sekundárních struktur do struktury terciární pak mohou disulfidové můstky, interakce s ionty kovů, van der Waalsovy síly, H-můstky apod.
PCR – co je potřeba
Metoda PCR (polymerase chain reaction – polymerázová řetězová reakce) slouží k namnožení předem definovaného malého množství úseků DNA do takové koncentrace, kdy je možné danou genetickou informaci detekovat. K celému procesu je nutná znalost sekvence nukleotidů v původní, tedy tzv. amplifikované, molekule DNA.
Celý proces je v mnohém podobný replikaci. Pro započetí reakce jsou zapotřebí dva primery (15-25 bází dlouhé úseky DNA), které nasedají na 3'-konec vláken původní DNA a které slouží jako startovací pozice pro DNA-polymerasu. Tento enzym, který katalyzuje růst nových řetězců DNA, pochází ze skupiny tzv. Taq-DNA-polymeras. Ty byly získány z termofilní bakterie Thermus aquaticus (proto Taq-polymerasy), která žije v blízkosti podmořských horkých pramenů (černých a bílých kuřáků). Díky tomu si enzym zachovává aktivitu i za vysokých teplot. Růst nových vláken DNA by se neobešel bez stavebních kamenů, deoxyribonukleotidů. Tak jako ve všech typech DNA i zde se objevují nukleotidy nesoucí čtyři dusíkaté báze: adenin, thymin, cytosin a guanin (Obr. 25).
Obr. 25 – Komponenty potřebné pro PCR.
Veškeré již zmíněné komponenty je nutné vložit do prostředí, ve kterém budou ideální podmínky pro průběh samotné polymerázové reakce (zejména pro aktivitu DNA-polymerasy). Jedná se zejména o stálou hodnotu pH. Toto prostředí navozuje pufrační roztok.
PCR – průběh
Metoda PCR (polymerase chain reaction) slouží k namnožení malého vzoru genetické informace, který je pak detekovatelný dalšími metodami analytické biochemie jako např. gelovou elektroforézou. Je také možné z velkého úseku DNA pomocí primerů (viz dále) vybrat jeden konkrétní gen, jehož nukleotidovou sekvenci známe, a nechat namnožit pouze ten.
Začátkem je třeba do pufračního roztoku v eppendorfově zkumavce napipetovat potřebné chemikálie o potřebné koncentraci: Taq-DNA-polymerasu, deoxyribonukleotidy, primery a samozřejmě vzorek DNA. Přístroj pro provádění PCR se nazývá thermocycler. Ten obsahuje blok jamek, do kterých lze zkumavky vkládat a který je následně schopen zvyšovat či snižovat teplotu podle předem daného nastavení.
Samotný průběh PCR se dělí do cyklů, čím více cyklů, tím více se DNA namnoží. Každý cyklus má 3 kroky. V prvním kroku se roztok s amplifikovanou (kopírovanou) DNA zahřívá na teplotu kolem 96 °C. Tím dochází k denaturaci celé molekuly (přerušení H-můstků mezi bázemi a rozvolnění celých vláken). V druhém kroku cyklu se teplota sníží na cca 55 °C a to z toho důvodu, aby na počáteční úseky množené části vláken DNA mohly nasednout deoxyribonukleotidové primery. Ty se s vlákny spojí opět pomocí H-můstků. Třetí krok cyklu je katalyzován termostabilní Taq-DNA-polymerázou. Teplota se v této fázi liší v závislosti na použité polymerase. Nejčastěji se jedná o enzym mající teplotní optimum mezi 75-80 °C. Polymerasa vytváří z deoxyribonukleotidů komplementární vlákna (Obr. 26). Těmito kroky jsme získali v jedné reakční směsi dvě kopie z jednoho úseku DNA obsahujícího gen, který potřebujeme detekovat. Při druhém cyklu získáme čtyři kopie, při třetím osm apod.
Obr. 26 – Znázornění třetího kroku prvního cyklu metody PCR.
Po skončení třetí fáze prvního cyklu se celý proces několikrát opakuje (např. 29x, tedy probíhá 30 cyklů) – viz Obr. 27. Z jedné molekuly DNA je tak možno na konci celého procesu získat až 1 miliardu namnožených úseků.
Obr. 27 - Znázornění třetího kroku druhého cyklu metody PCR.
Metoda PCR se využívá k mnoha účelům. Díky ní je možné detekovat infekční DNA ve vzorku (např. detekce virového proteinu z nosohltanové sliznice při vyšetření na onemocnění covid‑19), lze takto v genomu identifikovat dědičné choroby, či např. přiřadit vzorek neznámé tkáně ke konkrétnímu člověku, známe-li sekvenci jeho genomu.
*************************************************************************************************************