Milada Teplá
KUDCH, PřF UK v Praze
email: milada.tepla@natur.cuni.cz
Biochemie - základní kapitoly
Buňka - úvod
Nukleové kyseliny a proteosyntéza
Přírodní látky
Trávení
Metabolismus
- Základní pojmy
- Metabolismus sacharidů
- Metabolismus triacylglycerolů
- Metabolismus bílkovin
- Citrátový cyklus
- Vztahy mezi metabolismy
- Lokalizace pochodů v buňce
- Dýchací řetězec
- Fotosyntéza
- Photosynthesis
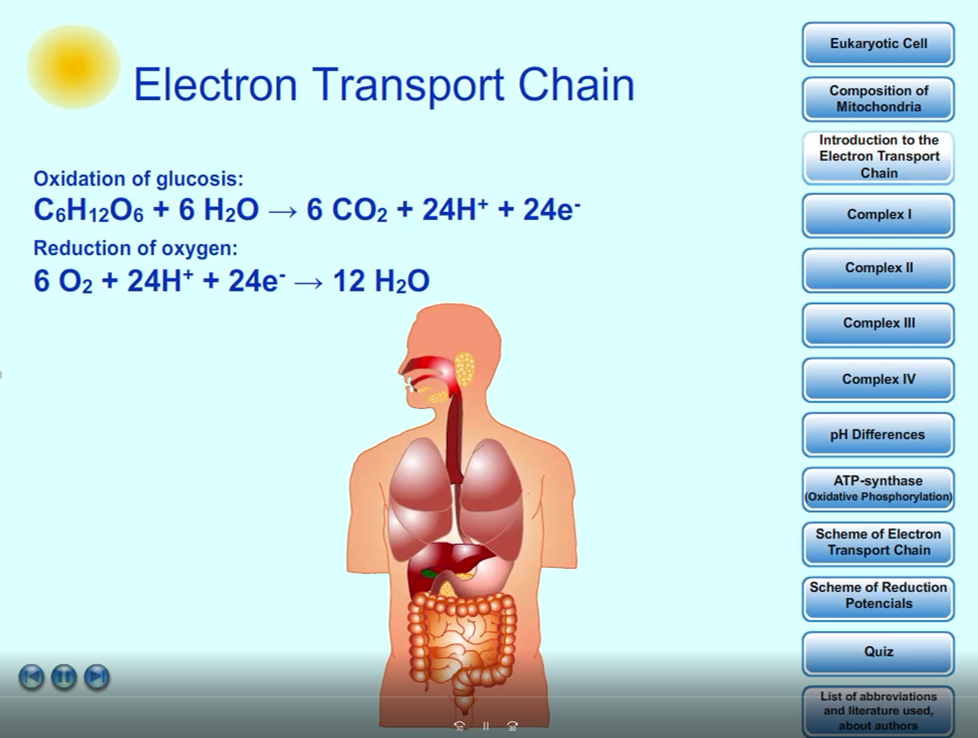
- Electron Transport Chain
- Výukové materiály
Další informace
Dýchací řetězec - úvod
Pro běžnou výuku ve vyšších ročnících gymnázia / střední školy doporučuji následující materiály (videa a studijní text):
Videa:
Studíjní text:
- kap. 1.: Úvod,
- kap. 2: Eukaryotní buňka
- kap. 3: Složení Mitochondrie
- kap. 4: Úvod do dýchacího řetězce a koenzymy NADH a FADH2 popř.
- Kap. 9: Syntéza ATP (oxidační fosforylace)
Dýchací řetězec - pro pokročilé
Pro výuku určenou do chemického/biologického semináře střední školy, vysokoškolskou výuku jsou určené náasledující materiály:
Videa
|
Úvod do dýchacího řetězce - video, youtube
|
|
|
|
Studíjní text:
Kapitoly:
1. Úvod
2. Eukaryotní buňka
3. Složení Mitochondrie
4. Úvod do dýchacího řetězce a koenzymy NADH a FADH2
5. Komplex I
6. Komplex II
7. Komplex III
8. Komplex IV
9. Syntéza ATP (oxidační fosforylace)
10. Schéma redoxních potenciálů
11. Kompletní schéma dýchacího řetězce
1. Úvod
Dýchání (respiraci) můžeme rozdělit na dvě rozdílné součásti jednoho procesu:
- • Vnější respirace. Kyslík je přenášen oběhovým systémem (srdce a krevní cévy) ke každé buňce organismu. Pokud by k tomu nedocházelo, tkáně by se nenapravitelně poškodily již během několika minut. Vnější respirace umožňuje vnitřní respiraci.
- • Vnitřní respirace (buněčné dýchání). Jedná se o soubor reakcí, které ukončují energetické odbourávání sacharidů, lipidů a bílkovin za účelem zisku energie s využitím kyslíku, na konci jsou produkty s nejnižším obsahem energie (CO2, H2O), tedy v oxidované formě. Proces probíhá v eukaryotních buňkách.
Sumární reakce dýchacího řetězce: C6H12O6 + 6 O2 + 6 H2O → 6 CO2 + 12 H2O
2. Eukaryotní buňka
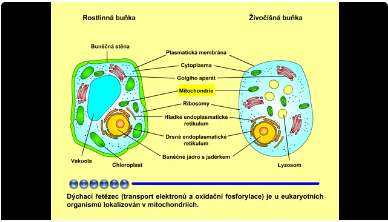
Eukaryotní buňky jsou dvojího typu: rostlinné a živočišné. Dýchací řetězec (transport elektronů skrze komplexy dýchacího řetězce a oxidační fosforylace) je u eukaryotních organismů lokalizován v mitochondriích.
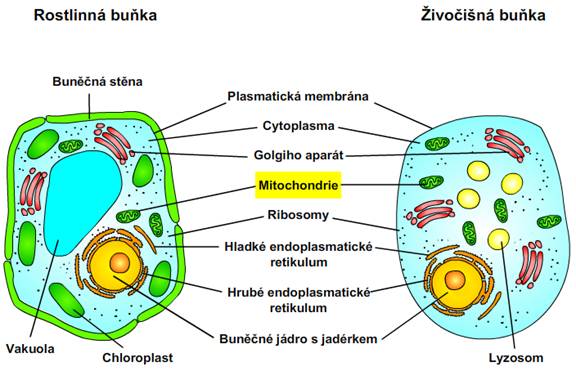
Obr. 1: Složení rostlinné a živočišné eukaryotní buňky. Viz též animace / video / youtube: https://youtu.be/55ygWOrav5o.
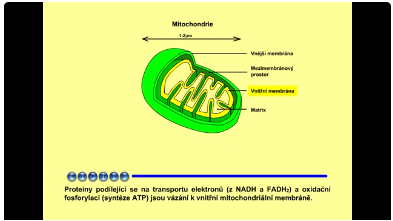
3. Složení mitochondrie
Mitochondrie jsou elipsoidní organely s vlastním genetickým aparátem. Obsahují dva typy membrán: vnější a vnitřní. Vnější membrána obsahuje protein porin, který umožňuje volnou difuzi. Vnitřní membrána je volně propustnou pouze pro O2, CO2 a H2O. Vnitřní membrána obsahuje transportní proteiny, které regulují průchod iontů, metabolitů a nízkomolekulárních sloučenin. Membrány určují dva oddělené prostory: mezimembránový prostor a matrix (gelovitou hmotu s obsahem vody menším než 50 %). Proteiny podílející se na transportu elektronů (z NADH a FADH2) a oxidační fosforylaci (syntéze ATP) jsou vázání k vnitřní mitochondriální membráně.
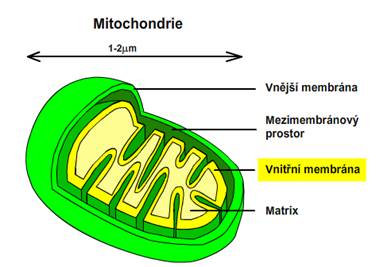
Obr. 2: Složení mitochondrie. Viz též animace / video / youtube: https://youtu.be/ZHNN_zsaU7M.
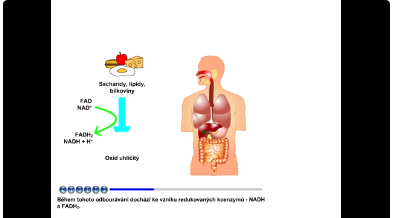
4. Úvod do dýchacího řetězce a koenzymy NADH a FADH2
Dýchací řetězec je souborem reakcí, které ukončují energetické odbourávání sacharidů, lipidů a bílkovin. Během tohoto odbourávání dochází ke vzniku redukovaných koenzymů - NADH a FADH2.
NADH (nikotinamidadenindinukleotid) se v dýchacím řetězci zpět oxiduje na NAD+ dle reakce: NADH + H+ → NAD+ + 2 H+ + 2 e-.
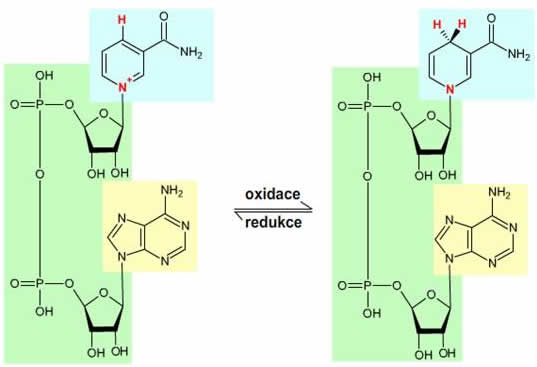
Obr. 3: Nikotinamidadenindinukleotidfosfát v oxidované (nalevo) a redukované podobě (napravo).
FADH2 (flavinadenindinukleotid) se v dýchacím řetězci zpět oxiduje na FAD dle reakce:
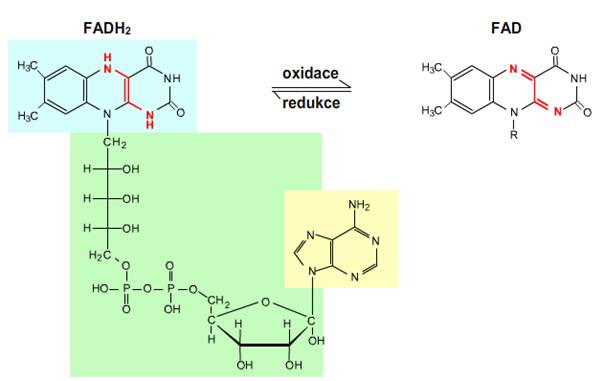
Obr. 4: Flavinadenindinukleotid.
Elektrony z redukovaných koenzymů jsou přenášeny po sérii akceptorů uspořádaných v dýchacím řetězci na elementární kyslík za vzniku vody. Protony z redukovaných koenzymů a z matrix mitochondrie jsou přenášeny do mezimembránového prostoru. Protony přecházejí zpět z mezimembránového prostoru do matrix. Při tomto přenosu dochází ke vzniku ATP (viz animace pH rozdíly a Syntéza ATP).
Viz též animace / video / youtube: https://youtu.be/68VRa_bS-FU.
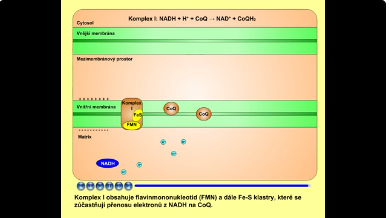
5. Komplex I
Komplex I (neboli NADH-ubichinonoxidoreduktasa) přenáší elektrony z NADH na koenzym Q (CoQ, ubichinon), který tím redukuje na ubichinol (CoQH2). Oxidace NADH je výrazně exergonickou reakcí (NADH je redukční činidlo):
- NADH + H+ + CoQ → NAD+ + CoQH2.
Komplex I obsahuje flavinmononukleotid (FMN) a dále Fe-S klastry, které se zúčastňují přenosu elektronů z NADH na CoQ.
Fe-S klastry obsahují ionty železa, které mění své oxidační stavy:
- Fe3+ + e- → Fe2+ → Fe3+ + e-.
Transport elektronů skrze komplex I: Dva elektrony a proton z NADH přechází na FMN za vzniku FMNH- a NAD+. Elekrony z FMNH-(po jednom) přecházejí na CoQ, který je postupně redukován na ubisemichinon CoQH• (radikál) a poté až na CoQH2 (ubichinol). Při navázání elektronu na CoQ dochází zároveň k navázání protonu H+ z matrix.
Během přenosu elektronů z NADH na CoQ skrze komplex I dochází k přenosu čtyř H+ z matrix do mezimembránového systému. Redukovaný ubichinol (CoQH2) je uvolněn z komplexu I a je nahrazen další molekulou oxidovaného ubichinonu (CoQ).
Oxidační stavy koenzymu Q (viz obr. 5):
- CoQ + H+ + e- → CoQH• (vznik ubisemichinonu - radikál);
CoQH• + H+ + e- → CoQH2 (vznik ubichinolu - redukovaná forma);
CoQH2 → CoQH• + H+ + e- (vznik ubisemichinonu - radikál);
CoQH• → CoQ + H+ + e- (vznik ubichinonu - oxidovaná forma).
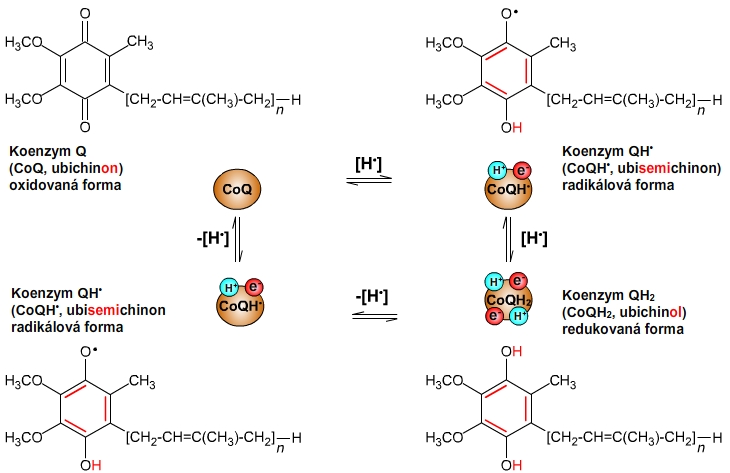
Obr. 5: Formy koenzymu Q. Komplex I Viz též animace / video / youtube: https://youtu.be/uQ6Rn-SVowA.
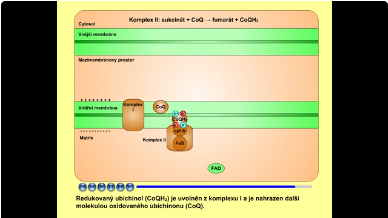
6. Komplex II
Komplex II (neboli sukcinát-ubichinonoxidoreduktasa) přenáší elektrony ze sukcinátu na koenzym Q (CoQ, ubichinon), který tím redukuje na ubichinol (CoQH2). Sukcinát se oxiduje na fumarát za vzniku redukovaného koenzymu FADH2. Jedná se o reakci, která je součástí citrátového cyklu.
Komplex II obsahuje cytochrom b (cyt b) a Fe-S klastry, které se zúčastňují přenosu elektronů z FADH2 na CoQ. Fe-S klastry i cyt b obsahují ionty železa, které mění své oxidační stavy:
- Fe3+ + e- → Fe2+ → Fe3+ + e-.
Transport elektronů skrze komplex II: Elekrony (vždy po jednom) přecházejí z FADH2 na koenzym Q. Oxidace FADH2 je exergonickou reakcí (FADH2 je redukční činidlo):
- FADH2 + CoQ → FAD + CoQH2
CoQ je postupně redukován na ubisemichinon CoQH• (radikál) a v následujícím kroku na CoQH2 (ubichinol). Redukovaný ubichinol (CoQH2) je uvolněn z komplexu I a je nahrazen další molekulou oxidovaného ubichinonu (CoQ).
Komplex II Viz též animace / video / youtube: https://youtu.be/qjmmZn1bXXU.
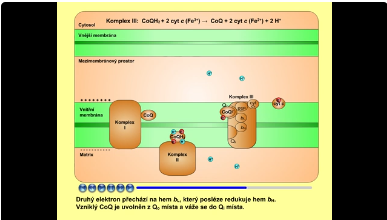
7. Komplex III
Komplex III (neboli ubichinol-cytochrom-c-oxidoreduktasa) přenáší elektrony z redukovaného koenzymu Q (ubichinolu, CoQH2) na cytochrom c :
- CoQH2 + cyt c (Fe3+) → CoQ + cyt c (Fe2+) + 2 H+
Komplex III obsahuje cytochrom b (cyt b), který váže dva hemy (bH a bL), cytochrom c1 (cyt c1) a Rieskeho Fe-S protein (ISP). Cytochromy a Rieskeho Fe-S protein obsahují ionty železa, které mění své oxidační stavy:
- Fe3+ + e- → Fe2+ → Fe3+ + e-.
Transport elektronů skrze komplex III: Mechanismus, kterým komplex III přebírá elektrony od CoQH2 se nazývá Q-cyklus, během kterého dochází k pumpování H+ z matrix do mezimembránového protoru. Jedním z meziproduktů Q-cyklu je stabilní CoQ•- semichinon.
Komplex III obsahuje dvě vazebná místa: Qo, který váže CoQH2, a Qi, který váže CoQ•- a CoQ.
CoQH2 (produkt komplexu I nebo II) se váže do Qo místa.
Jeden z elektronů je přenesen přes ISP na cyt c1 (a posléze až na cyt c), přičemž se uvolní dva protony do mezimembránového prostoru. Vzniká CoQ•-.
Druhý elektron přechází na hem bL, který posléze redukuje hem bH. Vzniklý CoQ je uvolněn z Qo místa a váže se do Qi místa.
Elektron z hemu bH přechází zpět na CoQ za opětovného vzniku CoQ•-:
- CoQH2 + cyt c1(Fe3+) → CoQ•- + cyt c1(Fe2+) + 2H+ (protony jsou přenesy do mezimembránového prostoru)
Jiná molekula CoQH2 se váže do Qo místa - děje se opakují.
Další elektron z hemu bH redukuje CoQ•- za současného navázání dvou protonů z matrix mitochondrie. Vzniká CoQH2.
Na každé dva CoQH2, které vstupují do Q-cyklu se jeden CoQH2 regeneruje.
Výsledkem je sumární reakce:
- CoQH2 + 2 cyt c1(Fe3+) + 2H+(matrix) → CoQ + 2 cyt c1(Fe2+) + 4H+ (mezimembránový prostor)
Komplex III Viz též animace / video / youtube: https://youtu.be/AWCkKTIItSY.
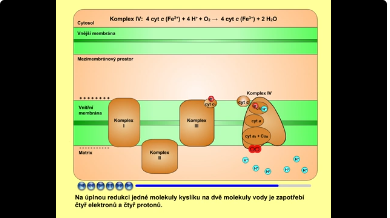
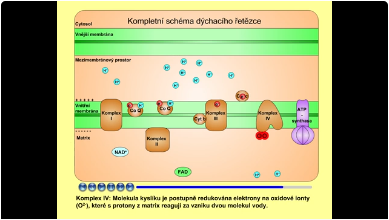
8. Komplex IV
Komplex IV (neboli cytochrom-c-oxidasa) katalyzuje oxidaci čtyř po sobě redukovaných molekul cytochromu c (cyt c) za současné redukce molekuly O2. Produktem je voda:
- 4 cyt c (Fe2+) + 02 + 4 H+ → 4 cyt c (Fe3+) + 2 H2O.
Komplex IV obsahuje CuA centrum, cytochrom a (cyt a) a binukleární komplex cytochromu a3 (cyt a3) a CuB centra. Cytochromy a Cu centra obsahují ionty železa a mědi, které mění své oxidační stavy:
- Fe3+ + e- → Fe2+ → Fe3+ + e-
- Cu2+ + e- → Cu+ → Cu2++ e-
Transport elektronů skrze komplex IV: Molekula O2 se váže do binukleárního centra. Cyt c slouží jako pohyblivý přenašeč elektronů z komplexu III na komplex IV. Elektrony jsou přenášeny z cyt c přes CuA centrum, cyt a a binukleární komplex cyt a3 a CuB centra až na kyslík. Molekula kyslíku je postupně redukována na O2- ionty, které s protony z matrix reagují za vzniku dvou molekul vody:
- 4 H+ + 4 e- + O2 → 2 H2O.
Na úplnou redukci jedné molekuly kyslíku na dvě molekuly vody je zapotřebí čtyř elektronů a čtyř protonů. Během přenosu čtyř elektronů skrze komplex IV dochází k přenosu čtyř protonů z matrix do mezimembránového prostoru:
- 4 cyt c (Fe2+) + 02 + 8 H+ (matrix) → 4 cyt c (Fe3+) + 2 H2O + 4 H+ (mezimembránový prostor)
Komplex IV Viz též animace / video / youtube: https://youtu.be/0OVxGYofkqo.
9. Syntéza ATP (oxidační fosforylace)
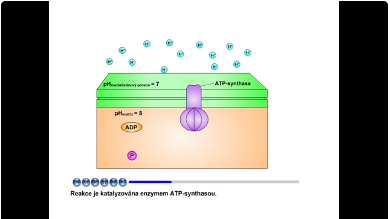
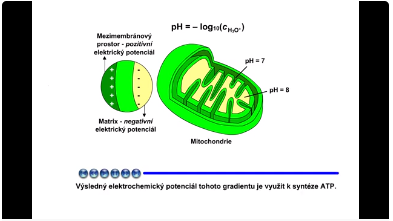
Během transportu elektronů dýchacím řetězcem vzniká volná energie. Tato energie způsobuje, že komplexy I, III a IV se zúčastní translokace protonů z matrix do mezimembránového prostoru. Vytváří se elektrochemický protonový gradient (koncentrace protonů je v mezimembránovém prostoru vyšší než v matrix). Matrix je oblast nízké koncentrace protonů a negativního elektrického potenciálu. Mezimembránový prostor je oblast vysoké koncentrace protonů a pozitivního elektrického potenciálu. Výsledný elektrochemický potenciál tohoto gradientu je využit k syntéze ATP.
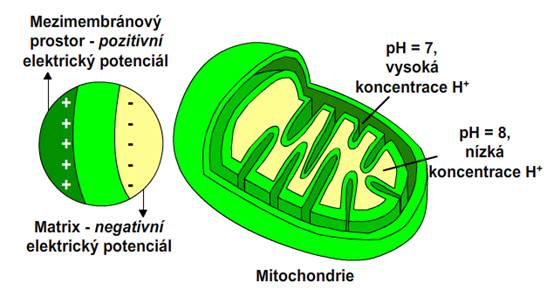
Obr. 6: pH rozdíly a elektrický potenciál v mitochondrii. Viz též animace / video / youtube: https://youtu.be/stIvZ2urM4I.
Syntéza ATP je endergonický proces, při kterém vzniká ATP (adenosintrifosfát) z ADP (adenosindifosfát) a P (anorganický fosfát). Reakce je katalyzována enzymem ATP-synthasou a je poháněna transportem protonů (viz animace pH rozdíly). Protony přecházejí skrze ATP-synthasu z mezimembránového prostoru zpět do matrix mitochondrie. Vzniká tak energie, která je využita k syntéze ATP. Předpokládá se, že na vznik jedné molekuly ATP je zapotřebí zpětného přenosu tří až čtyř protonů. Tato syntéza ATP se nazývá oxidační fosforylace.
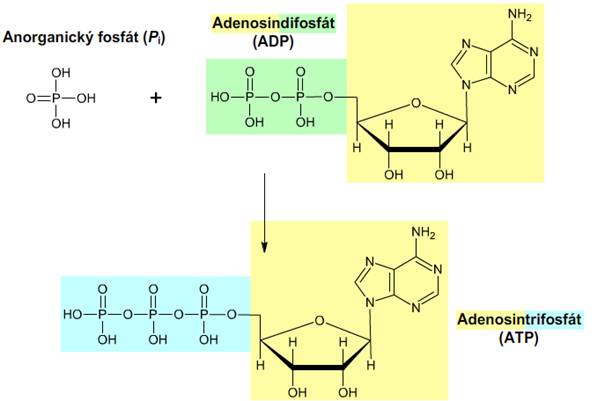
Obr. 7: ATP. Viz též animace / video / youtube: https://youtu.be/R8-XFLjAziM.
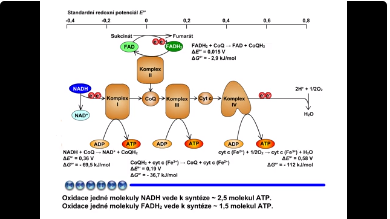
10. Schéma redoxních potenciálů
Afinita oxidovaného substrátu k elektronům vzrůstá s jeho standardním redoxním potenciálem E°' .
Kyslík má velkou afinitu k elektronům (kyslík je silné oxidační činidlo):
- 1/2O2 + 2H+ + 2e- → H2O; ΔE°' = 0,815 V.
NAD+ má malou afinitu k elektronům (NAD+ je slabé oxidační činidlo; NADH je silné redukční činidlo):
- NAD+ + H+ + 2e- → NADH; ΔE°' = - 0,315 V.
NADH je v tomto spojení donorem elektronů a O2 je akceptorem elektronů. Celková reakce:
- 1/2O2 + NADH+ + H+ ↔ H2O + NAD+; ΔE°' = 0,815 - (-0,315) = 1,130 V
Změna standardní volné energie pro tuto reakci: ΔG°' = -nFΔE°' = (-2 x 96 485 x 1,13) kJ/mol = -218 kJ/mol
Energie potřebná na vznik jedné molekuly ATP z ADP a fosfátu je rovna 30,5 kJ/mol (jedná se o standardní volnou energii, ΔG°').
Oxidace jedné molekuly NADH vede k syntéze ~ 2,5 molekul ATP. Oxidace jedné molekuly FADH2 vede k syntéze ~ 1,5 molekul ATP.
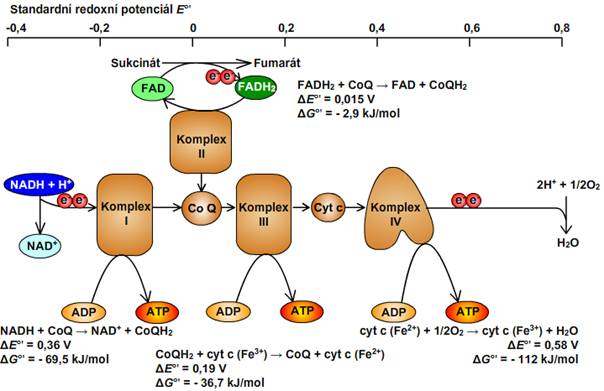
Obr. 8: Schéma redoxních potenciálů. Viz též animace / video / youtube: https://youtu.be/fWEaic0Pj3Q.
(Pozn. Hodnoty ΔE°' a ΔG°' převzaty z Voet, 2011.)
(Pozn. Standardní redoxní potenciál E°' je napětí generované při reakci poločlánku za standardních biochemických podmínek (při koncentraci výchozích látek a produktů rovnající se 1mol/l a s koncentrací [H+] definovanou jako 1 při pH = 7) vztažených ke standardní vodíkové elektrodě. Rozdíl standardního redoxního potenciálu ΔE°' redoxní rovnice lze vyjádřit takto: ΔE°' = E°'(akceptor) - E°'(donor) .)6
(Pozn. Změna standardní volné energie může být vypočítána z rovnice:
ΔG°' = -nFΔE°', kde F (Faradayova konstanta) pro elektron je 96 494 C/mol a n je počet přenesených elektronů na mol reaktantů.)
11. Kompletní schéma dýchacího řetězce
Viz obrázek 9 a 10 níže a též animace:
Viz též animace / video / youtube: https://youtu.be/rVc5u2oKoug.
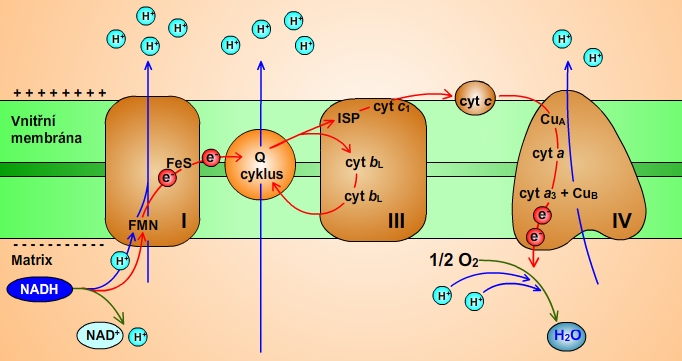
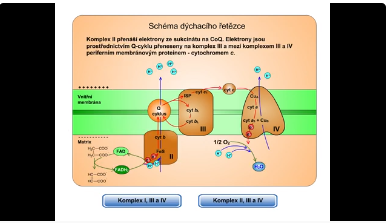
Obr. 9: Schéma dýchacího řetězce (komplex I, III a IV): Elektrony jsou přenášeny mezi komplexem I a komplexem III v membráně rozpustným CoQ (prostřednictvím Q-cyklu) a mezi komplexem III a IV periferním membránovým proteinem - cytochromem c.
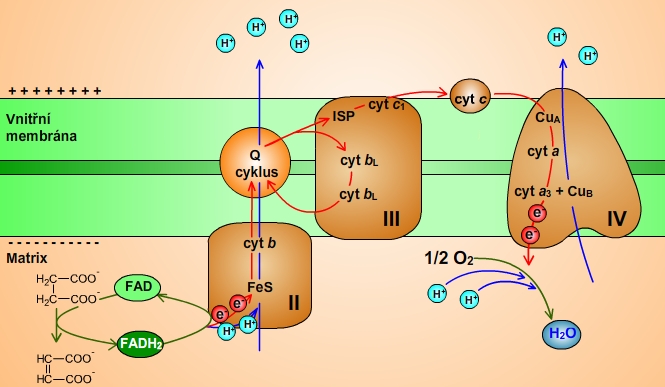
Obr. 10: Schéma dýchacího řetězce (komplex I, III a IV): Komplex II přenáší elektrony ze sukcinátu na CoQ. Elektrony jsou
prostřednictvím Q-cyklu přeneseny na komplex III a mezi komplexem III a IV periferním membránovým proteinem - cytochromem c.
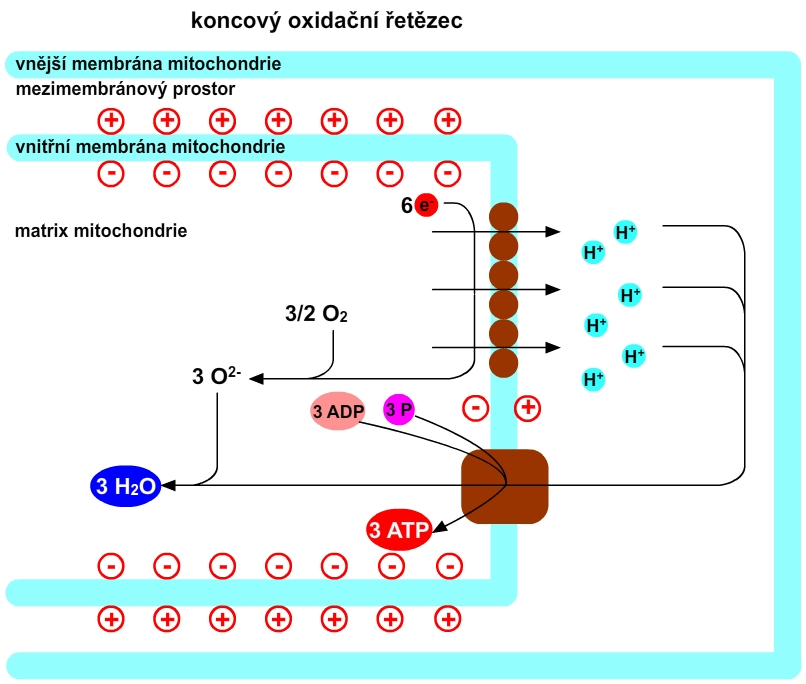
Obr. 11: Zjednodušené schéma dýchacího řetězce.
12. Kvíz
Obr. 12: Kvíz video / https://youtu.be/hiV3jYm0w64
13. Použitá literatura
Voet, D. J.; Voet, J. G. Biochemistry, 4th ed.; John Wiley & Sons, Inc.: United States of America, 2011; pp 823-870.