Milada Teplá
KUDCH, PřF UK v Praze
email: milada.tepla@natur.cuni.cz
Biochemie - základní kapitoly
Buňka - úvod
Nukleové kyseliny a proteosyntéza
Přírodní látky
Trávení
Metabolismus
- Základní pojmy
- Metabolismus sacharidů
- Metabolismus triacylglycerolů
- Metabolismus bílkovin
- Citrátový cyklus
- Vztahy mezi metabolismy
- Lokalizace pochodů v buňce
- Dýchací řetězec
- Fotosyntéza
- Photosynthesis
- Electron Transport Chain
- Výukové materiály
Další informace
Přírodní látky: Enzymy
Kapitoly:
1. Co jsou enzymy?
2. Jaká je funkce enzymů?
3. Kde se enzymy nachází?
4. V čem enzymy předčí ostatní umělé biokatalyzátory?
5. Jaká je klasifikace a názvosloví enzymů?
6. Jaká je struktura enzymu?
7. Jak rozdělujeme enzymy?
8. Co ovlivňuje enzymovou aktivitu?
9. Jaké známe druhy reverzibilní inhibice?
1. Co jsou enzymy?
Enzymy jsou biokatalyzátory, které se podílejí na řízení a koordinaci vysoce integrovaného souboru chemických reakcí v organismu. Enzymy mají povahu složených bílkovin nebo jsou tvořeny molekulou RNA (ribozymy).(citace Vodrážka 1998b)
2. Jaká je funkce enzymů?
Hlavní funkce enzymů je katalytická. Enzymy umožňují průběh takových reakcí, které by v lidském těle za normálních podmínek neprobíhaly, neboť většina biochemických reakcí má příliš vysokou aktivační energii (minimální energie potřebná pro uskutečnění termické reakce). Probíhá-li ale reakce s enzymem, průběh reakce je značně ulehčen, neboť katalyzovaná reakce má podstatně nižší aktivační energii.(citace Vodrážka 1998b)
Viz též animace Katalytické působení enzymu (graf).
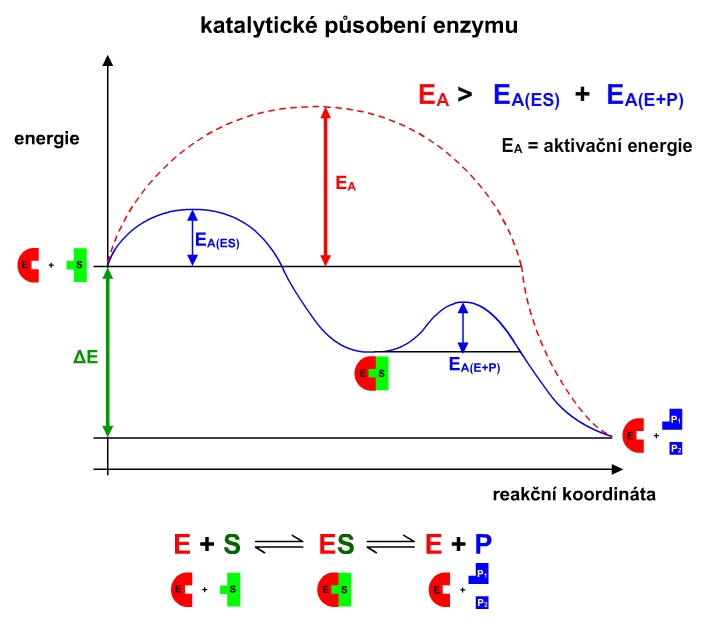
Obr. 1: Závislost energie na průběhu chemické reakce.
3. Kde se enzymy nachází?
Enzymy nacházíme ve všech živých systémech a předpokládá se, že i jednodušší buňky obsahují přes 300 enzymů, které řídí rychlosti prakticky všech reakcí v nich probíhajících.(citace Vodrážka 1998b)
4. V čem enzymy předčí ostatní umělé biokatalyzátory?
Enzymy jsou oproti umělým biokatalyzátorům účinnější. Jediná molekula enzymu je schopna během jedné sekundy přeměnit až 5.104 molekul substrátu, výjimečně i více. To odpovídá značným reakčním rychlostem, které až o několik řádů převyšují rychlosti dějů realizovaných umělými katalyzátory.(citace Vodrážka 1998b)
Pracují většinou za mírných podmínek (teplota 20-40 °C, tlak 0,1 MPa, pH většinou kolem 7).(citace Vodrážka 1998b)
Jejich účinek lze snadno regulovat, a to dokonce na několika úrovních.
Nezanedbatelnou předností enzymů při jejich průmyslových aplikacích je i jejich metodičnost, na rozdíl od umělých katalyzátorů, které jsou většinou toxické.(citace Vodrážka 1998b)
Enzymy se dále vyznačují značnou specifitou:
- prvním typem je tzv. substrátová specifita, tzn. každý enzym obvykle katalyzuje pouze určitou reakci určitého substrátu (výchozí látky);(citace Vodrážka 1998b)
- druhým typem je tzv. specifita účinku, tzn. určitý enzym katalyzuje pouze jednu z mnoha možných přeměn substrátu;(citace Vodrážka 1998b)
- třetím typem je tzv. stereospecifita, tzn. schopnost enzymu rozpoznat v racemické směsi jeden z enantiomerů a pouze ten přeměnit, dále při syntéze chirální molekuly z achirální syntetizovat pouze jediný z možných enantiomerů; stereospecifita je důsledkem toho, že enzym (a tedy i jeho aktivní centrum) je vybudován z chirálních monomerních jednotek, a je proto chirální jako celek.(citace Kodíček)
5. Jaká je klasifikace a názvosloví enzymů?
V prvních dobách studia byly enzymům dávány celkem náhodné triviální názvy, většinou s koncovkou –in (např. pepsin, trypsin). Později byla pro enzymy zvolena koncovka –asa a název byl vytvořen podle substrátu, jehož přeměnu enzym katalyzoval (amylasa, lipasa, proteasa) nebo podle charakteru katalyzované reakce (oxidasa, hydrolasa, transaminasa).(citace Vodrážka 1998b)
Bližší poznávání stále rostoucího počtu enzymů si však vynutilo řešení problému účelného třídění a jednotné nomenklatury. Vedle doporučovaných triviálních názvů byly zavedeny systematické názvy enzymů, v nichž je zahrnut substrát i typ katalyzované reakce.(citace Vodrážka 1998b)
Kromě systematického názvu je každému enzymu přiděleno kódové číslo, které enzym jednoznačně identifikuje. Např. pro laktátdehydrogenasu je kódové číslo E.C.1.1.1.27. První číslo kódu značí hlavní třídu enzymů, druhé číslo podtřídu, v tomto případě oxidaci primární alkoholové skupiny, třetí číslo určuje typ akceptoru vodíku, v tomto případě se jedná o enzym spolupracující s pyridinovými koenzymy a čtvrté číslo je pořadové číslo konkrétního enzymu v dané podskupině.(citace Sofrová)
6. Jaká je struktura enzymu?
Většina enzymů je bílkovinné povahy, výjimkou je např. ribozym, který je tvořen RNA. Některé enzymy jsou tvořeny pouze polypeptidovým řetězcem či řetězci. Jiné enzymy většinou obsahují ještě neproteinovou složku nazývanou kofaktor. Kofaktorem může být buď nízkomolekulární látka zvaná koenzym, která není pevně vázána na enzym, nebo pevně vázaná struktura, tzv. prostetická skupina.
Katalyticky aktivní komplex protein-kofaktor se nazývá holoenzym, proteinová část enzymu po odstranění kofaktoru se nazývá apoenzym.
Nejdůležitější částí molekuly enzymu je aktivní místo (centrum). Do aktivního místa (centra) se pomocí vazebných skupin vážou substráty a jsou v něm přeměňovány pomocí katalytických skupin na produkty.
Některé enzymy mají na povrchu svých makromolekul několik aktivních center, působících nezávisle na sobě. Aktivní centrum je výsledkem terciární (u některých enzymů kvartérní) struktury apoenzymu a má charakteristický tvar (= charakteristické prostorové uspořádání atomů a charakteristických skupin). K aktivnímu centru je buď trvale, nebo dočasně připojen kofaktor. Kofaktor v chemické přeměně substrátu vystupuje jako dárce nebo příjemce elektronů (redoxní reakce), kationtů vodíku (acidobazické reakce) nebo charakteristických skupin. "Darování" nebo příjem jsou děje navzájem spojené. V jedné reakci kofaktor odebírá substrátu elektron, proton nebo charakteristickou skupinu a v následující chemické reakci je poskytne jinému substrátu. Aktivní centrum je nejdůležitější část enzymu. Pouze na aktivním centru probíhá katalýza biochemické reakce.(citace: Jak probíhá enzymová reakce? URL: http://www.chesapeake.cz/chemie/download/skripta/biochemie.pdf . [online]. [cit. 26.12.2008].)
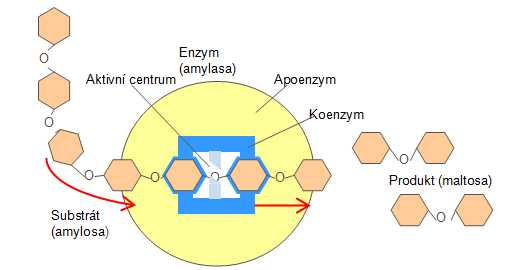
Obr. 2: Schematické znázornění struktury a působení enzymu amylasy.
6. Jak probíhá enzymová reakce?
Mechanismus katalytického působení enzymu je přibližně následující: (citace: Jak probíhá enzymová reakce? URL: http://www.chesapeake.cz/chemie/download/skripta/biochemie.pdf . [online]. [cit. 26.12.2008].)
- a) na bílkovinnou část aktivního centra se váží strukturní jednotky substrátu; tak vzniká enzym-substrátový komplex; vytvořením enzym-substrátového komplexu se mnohonásobně zvýší koncentrace substrátu na aktivním centru; to vede ke zvýšení rychlosti chemické reakce v souladu s kinetickou rovnicí;
- b) připojením strukturních jednotek substrátu k aktivnímu centru se zeslabí některé chemické vazby ve strukturních jednotkách substrátu; tyto chemické vazby proto pro své rozštěpení potřebují podstatně nižší aktivační energii; vznikem enzym-substrátového komplexu se výrazně sníží aktivační energie dané reakce;
- c) enzym-substrátový komplex se po vzniku nových chemických vazeb rozpadá na enzym a produkty.
enzym + substrát → enzym-substrátový komplex → enzym + produkt
E + S → ESK → E + P
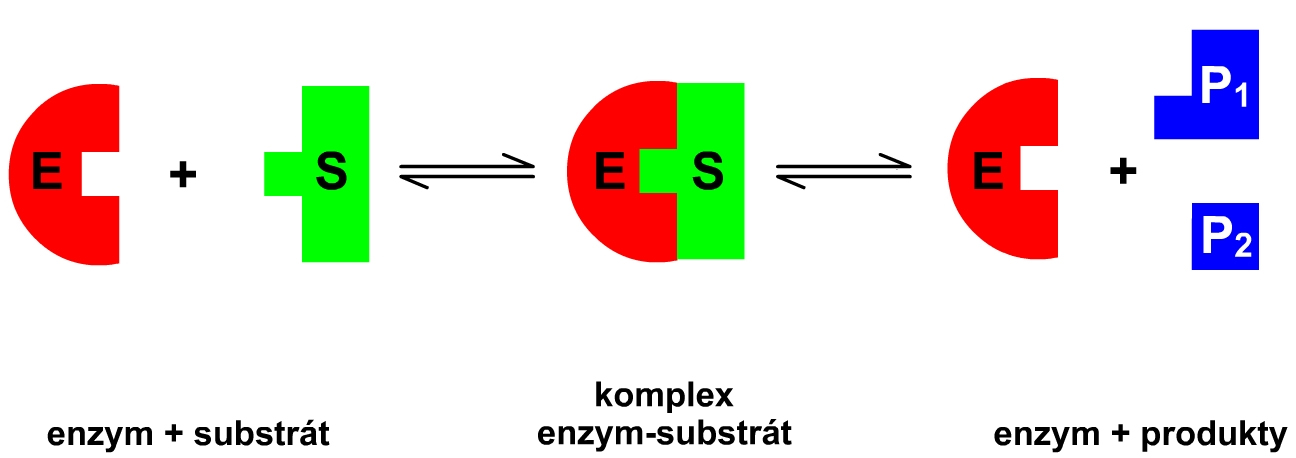
Obr. 3: Schematické znázornění reakce katalyzované enzymem.
Viz animace: Schématické znázornění reakce katalyzované enzymem (graf).
7. Jak rozdělujeme enzymy?
Enzymy jsou rozděleny do šesti hlavních tříd:
1. Oxidoreduktasy
Tyto enzymy katalyzují oxidoredukční reakce (tj. přenos elektronů, vodíků nebo reakce s kyslíkem). Mezi oxidoreduktasy patří např. alkoholdehydrogenasa (ADH) katalyzující přeměnu ethanolu na acetaldehyd a laktátdehydrogenasa (LDH), která katalyzuje přeměnu laktátu na pyruvát.

Obr. 4: Působení enzymu laktátdehydrogenasy.
2. Transferasy
Jedná se o enzymy, katalyzující přenos skupin atomů. Příkladem transferasy může být aminotransferasa nebo glutamyltransferasa, katalyzující přenos aminoskupin.

Obr. 5: Působení enzymu glutamyltransferasy.
3. Hydrolasy
Hydrolasy katalyzují hydrolytické štěpení vazeb. Mezi hydrolasy patří např. lipasy, které katalyzují hydrolýzu esterových vazeb.
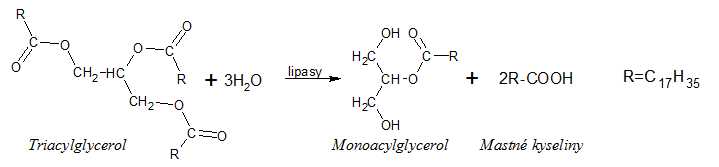
Obr. 6: Působení enzymu lipasy.
4. Lyasy (synthasy)
Tyto enzymy katalyzují nehydrolytické štěpení vazeb nebo tvorbu vazeb. Příkladem může být enzym pyruvátdekarboxylasa, která katalyzuje odštěpení CO2 z molekuly pyruvátu za vzniku acetaldehydu.

Obr. 7: Působení enzymu pyuvátdekarboxylasy.
5. Isomerasy
Isomerasy katalyzují isomerační reakce. Příkladem může být triosafosfátisomerasa, katalyzující přeměnu D-glyceraldehyd-3-fosfátu na dihydroxyacetonfosfát.

Obr. 8: Působení enzymu triosafosfátisomerasy.
6. Ligasy (synthetasy)
Katalyzují vznik vazeb za současného rozštěpení makroergické fosfátové vazby (např. v ATP). Příkladem může být aminoacyl-tRNA-synthetasa (viz Translace). Dalším příkladem je enzym pyruvátkarboxylasa, který katalyzuje reakci:
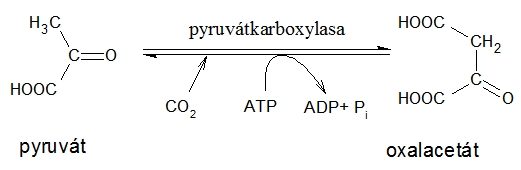
Obr. 9: Působení enzymu pyruvátkarboxylasy.
6. Co je enzymová aktivita?
Činnost enzymů úzce souvisí s jejich aktivitou. Aktivita enzymů je definována jako rychlost katalyzované reakce. Její základní jednotkou je katal. 1 katal (kat) vyjadřuje množství enzymu, které způsobí přeměnu jednoho molu substrátu za sekundu. Z praktického hlediska je tato jednotka příliš veliká, proto se používají její zlomky (μkat nebo nkat).(citace Vodrážka 1998b)
8. Co ovlivňuje enzymovou aktivitu?
Enzymová aktivita je ovlivněna mnoha faktory:
- a) teplota: rychlost všech reakcí, tedy i enzymově katalyzovaných, vzrůstá s rostoucí teplotou; pokud však u enzymových reakcí přestoupí teplota kritickou hodnotu, dojde k tepelné denaturaci bílkovinné molekuly enzymu a rychlost enzymové reakce začne klesat; největší aktivita enzymů je většinou při teplotě kolem 37 °C, většina enzymů ztrácí aktivitu při teplotě kolem 55-60°C; existují však enzymy termofilních bakterií, které jsou aktivní i při 85 °C;(citace Kolář, Kodíček)
- b) pH: většina enzymů katalyticky působí jen v určité oblasti pH (tzv pH-optimum); tato vlastnost souvisí s disociačním stavem kyselých a bazických skupin aktivního centra; většina enzymů má pH-optimum v neutrálním či slabě kyselém prostředí, extrémních hodnot dosahuje pH-optimum trávicích enzymů;(citace Kolář, Kodíček)
- c) modulátory: (citace: Aktivita enzymů. URL: http://projektalfa.ic.cz/enzymy.htm. [online]. [cit.26.12.2008])
- I. látky zvyšující rychlost enzymové reakce = aktivátory; enzymy jsou nejčastěji vylučovány v neaktivní formě v podobě proenzymů neboli zymogenů; ty se vlivem reakčního prostředí nebo přítomností aktivátoru mění na aktivní formu; probíhá to tak, že aktivátor obnaží aktivní místo čímž se enzym stane aktivním a začne plnit svojí funkci;
- II. látky snižující rychlost enzymové reakce = inhibitory; některé látky ovlivňují aktivitu enzymů tím, že se na ně váží nebo ovlivňují vazbu mezi enzymem a substrátem; některé látky napodobují substrát a tím blokují aktivní místo; existují také látky, které změní strukturu enzymu a ten se stane nefunkčním.
Viz též animace: Faktory ovlivňující rychlost chemické reakce (grafy) a Regulace enzymové aktivity (allosterické enzymy a kovalentně modulované enzymy) (animace).
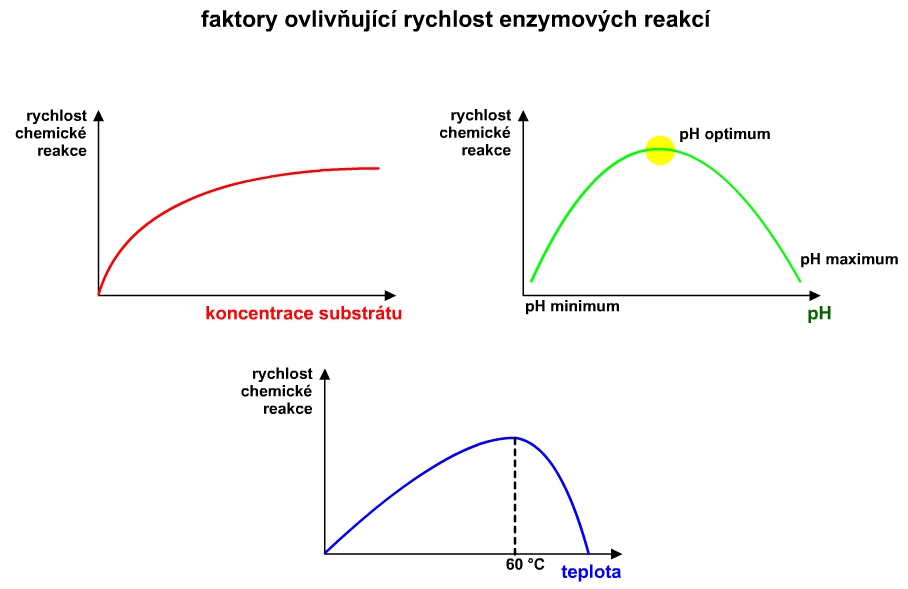
Obr. 10: Závislost rychlosti katalyzované reakce na koncentraci substrátu, na pH a na teplotě.
9. Jaké známe druhy reverzibilní inhibice?
Je známo několik druhů reverzibilních inhibicí:
a) Kompetitivní inhibice: čistá reversibilní inhibice, při níž inhibitor soutěží o vazbu na enzym se substrátem; často mají inhibitor a substrát podobnou chemickou strukturu a váží se do stejného vazebného místa; z teorie chemických rovnováh vyplývá, že vysokou koncentrací substrátu lze inhibitor vytěsnit z vazby na enzym a tím zrušit jeho působení. (citace Kodíček) Viz animace: Kompetitivní inhibice.
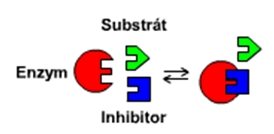
Obr. 11: Kompetitivní inhibice.
b) Nekompetitivní inhibice: čistá reversibilní inhibice, při níž vazba inhibitoru na enzym neovlivňuje vazbu substrátu; může tedy existovat komplex enzym-substrát-inhibitor; enzym má při tomto typu inhibice specifické vazebné místo pro inhibitor; vazbou inhibitoru je porušena schopnost enzymu přeměňovat substrát, a to buď vyvoláním konformační změny polypeptidového řetězce, v jejímž důsledku se katalytické skupiny dostávají do nevýhodného postavení, nebo omezením možnosti konformačních změn, které jsou pro průběh katalyzované reakce nezbytné. (citace Kodíček) Viz animace: Nekompetitivní inhibice.
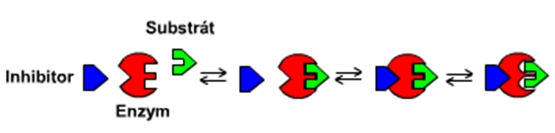
Obr. 12: Nekompetitivní inhibice.
c) akompetitivní inhibice: čistá reversibilní inhibice, při níž se inhibitor může vázat pouze na komplex enzym-substrát, nikoli však na volný enzym; vazbou inhibitoru je porušena schopnost enzymu přeměňovat substrát a nevzniká produkt; (citace Kodíček) Viz animace: Akompetitivní inhibice.
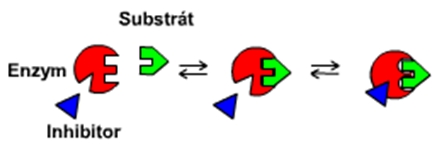
Obr. 13: Akompetitivní inhibice (Inhibitor se může vázat pouze na komplex enzym-substrát).
d) allosterická inhibice: snížení aktivity enzymu vyvolané reversibilní vazbou inhibitoru mimo oblast aktivního centra, kam se váže substrát; vazba inhibitoru vyvolává konformační změnu, v jejímž důsledku je enzym inaktivován; v užším smyslu se tento termín užívá pro zvláštní typ inhibice, při níž je vazbou inhibitoru ovlivňována kvartérní struktura allosterických enzymů.(citace Kodíček)