Milada Teplá
KUDCH, PřF UK v Praze
email: milada.tepla@natur.cuni.cz
Biochemie - základní kapitoly
Buňka - úvod
Nukleové kyseliny a proteosyntéza
Přírodní látky
Trávení
Metabolismus
- Základní pojmy
- Metabolismus sacharidů
- Metabolismus triacylglycerolů
- Metabolismus bílkovin
- Citrátový cyklus
- Vztahy mezi metabolismy
- Lokalizace pochodů v buňce
- Dýchací řetězec
- Fotosyntéza
- Photosynthesis
- Electron Transport Chain
- Výukové materiály
Další informace
Přírodní látky: Bílkoviny
Kapitoly:
1. Jaké je rozdělení, složení a funkce bílkovin?
2. Jaká je struktura bílkovin?
3. K čemu dochází během denaturace bílkovin?
4. Jaké enzymy se podílejí na trávení bílkovin?
1. Jaké je rozdělení, složení a funkce bílkovin?
Bílkoviny neboli proteiny jsou organické sloučeniny, které jsou složeny z mnoha aminokyselinových zbytků spojených peptidovou vazbou (-CO-NH-). V bílkovinách se pravidelně vyskytuje pouze 21 tzv. kódovaných aminokyselin, pro které existuje genetický kód (viz Translace).
(Struktura a disoaciace aminokyselin - viz dále animace Obecný vzorec aminokyselin a Disoaciace aminokyselin)
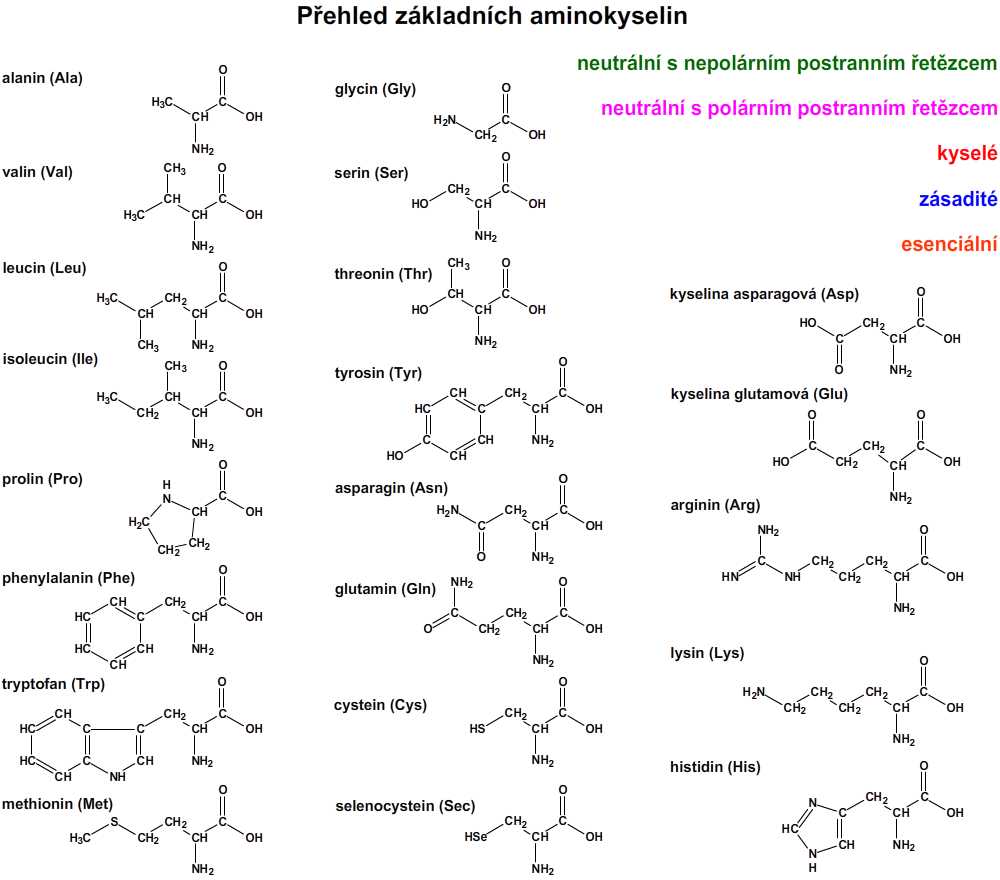
Obr. 1: Přehled základních aminokyselin.
Peptidový řetězec začíná aminokyselinou, která má volnou aminoskupinu (tzv. N-koncová aminokyselina) a končí aminokyselinou, která má volnou karboxylovou skupinu (tzv. C-koncová aminokyselina) – viz obr. 2.
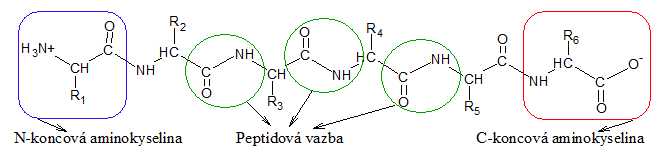
Obr. 2: Peptidový řetězec.
Podle počtu aminokyselin v peptidovém řetězci rozlišujeme dipeptidy (2 aminokyseliny), tripeptidy (3 aminokyseliny), oligopeptidy (méně než 10 aminokyselin), polypeptidy (10 až 50 aminokyselin) a bílkoviny neboli proteiny (více než 50 aminokyselin).
Podle celkového uspořádání peptidových řetězců rozlišujeme dva hlavní typy proteinů: globulární (sféroproteiny) a fibrilární (skleroproteiny). U globulárních bílkovin (např. ovalbumin) jsou peptidové řetězce sbaleny do klubíčka u fibrilárních bílkovin (např. kolagen) jsou řetězce „natažené“.
Podle složení bílkoviny rozdělujeme na jednoduché a složené. Jednoduché bílkoviny obsahují pouze aminokyseliny, kdežto složené bílkoviny obsahují kromě aminokyselin i další nepeptidové složky:
- - glykoproteiny (např. imunoglobulin) – jedná se o látky tvořené proteinem vázaným na sacharid; bílkovinná složka převažuje;
- - proteoglykany (např. peptidoglykan murein) – jsou také tvořeny proteinem a sacharidem, zde však převažuje sacharidová složka;
- - lipoproteiny (např. lipoproteiny krevního séra) – k bílkovině je vázán zbytek lipidu;
- - metaloproteiny (např. hemoglobin) – součástí bílkovin jsou ionty kovů; mezi metaloproteiny patří i tzv. hemoproteiny, jejichž součástí jsou aromatické sloučeniny zvané hem;
- - fosfoproteiny (např. kasein) - trvalou součástí v těchto bílkovinách je fosfátová skupina.
Funkce bílkovin v lidském těle je velice rozmanitá. Bílkoviny slouží jako enzymy (např. trypsin), regulují průběh dějů v živých organismech (některé hormony), mají podpůrnou funkci (např. kolagen), zprostředkovávají transport látek (např. hemoglobin), mají ochrannou funkci (např. imunoglobulin) aj. Jako zdroj energie mohou být bílkoviny nahrazeny sacharidy či lipidy, avšak jsou zásadním zdrojem dusíku a esenciálních aminokyselin.
2. Jaká je struktura bílkovin?
To, z jakých aminokyselinových zbytků je bílkovina složena, není postačující k objasnění její funkce a vlastností.
Velmi důležitým kriteriem vedle pořadí aminokyselinových zbytků v peptidovém řetězci (primární struktura) je také prostorové uspořádání celé molekuly bílkoviny (vyšší struktury). Každá bílkovina má unikátní dokonale organizovanou a účinně stabilizovanou prostorovou strukturu.
Při popisu trojrozměrného uspořádání proteinů jsou rozlišovány 4 úrovně: primární, sekundární, terciární a kvartérní struktura.
1. Primární struktura
Primární struktura je dána pořadím (sekvencí) aminokyselinových zbytků v peptidovém řetězci.
2. Sekundární struktura
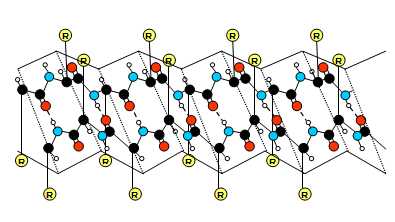
Jedná se o prostorové uspořádání peptidových vazeb (páteře polymeru). Tato struktura je výsledkem vzniku vodíkových vazeb, především mezi protilehlými skupinami NH a CO. Výsledkem tohoto působení jsou dvě struktury: α-helix (peptidový řetězec je stočen do šroubovice) a β-struktura neboli struktura skládaného listu (polypeptidový řetězec je v této struktuře skoro úplně rozvinut a má podobu skládaného listu).
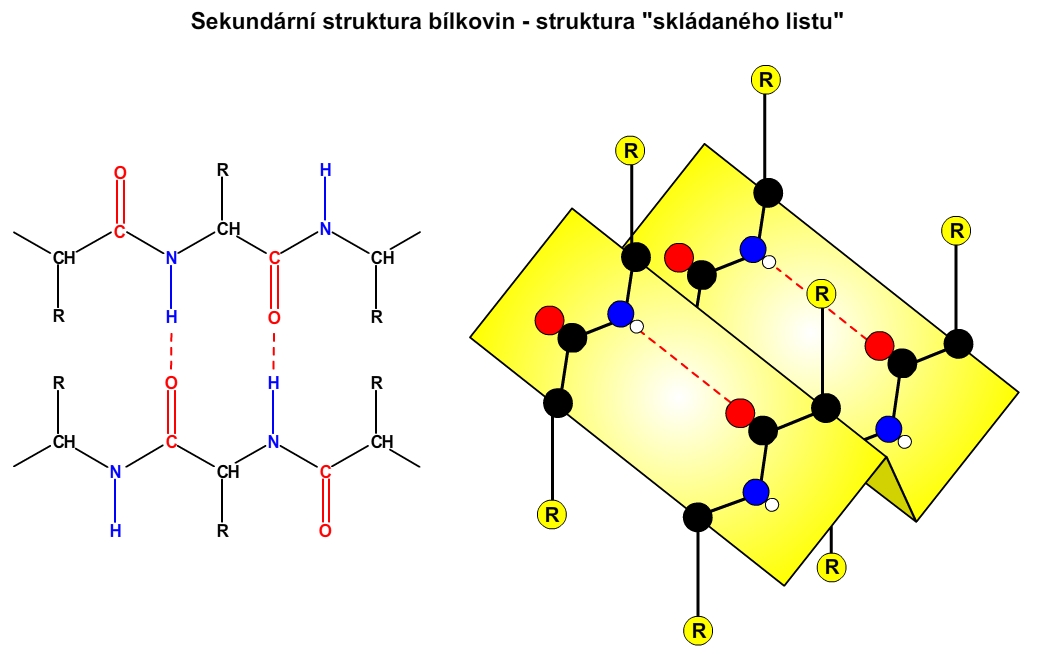
Obr. 3: β-struktura.
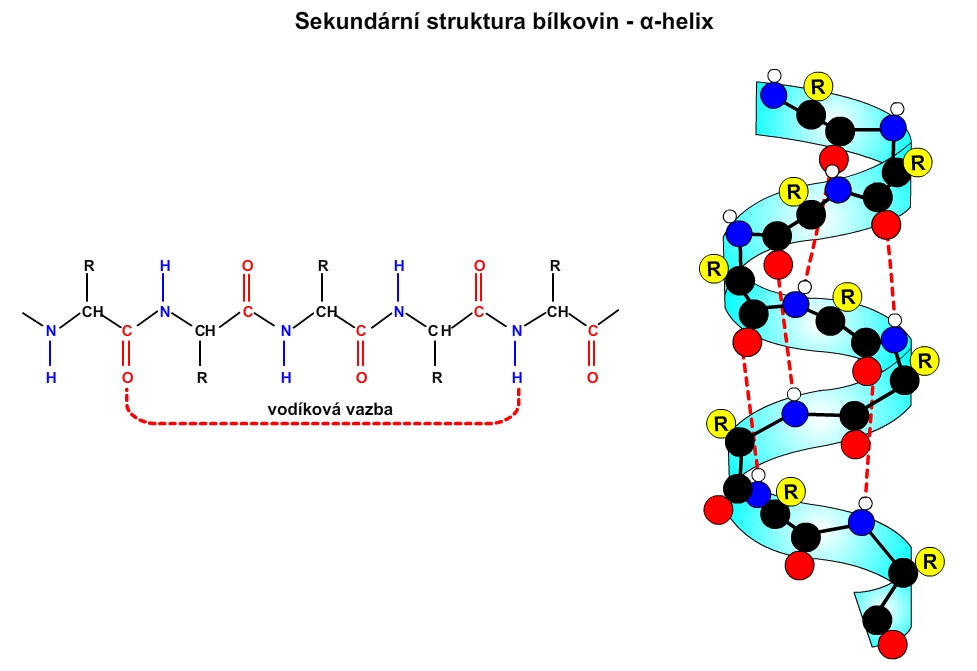
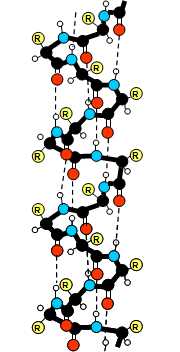
Obr. 4:α-helix.
Struktura některých shluků jednotlivých úseků sekundární struktury se nazývá supersekundární struktura.
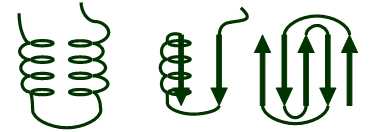
Obr. 5: Supersekundární struktura.
3. Terciární struktura
Terciární struktura se vztahuje k prostorovému uspořádání aminokyselinových zbytků umístěných v lineární sekvenci daleko od sebe; hranice mezi sekundární a terciární strukturou je v některých případech těžko definovatelná.(citace Sofrová)
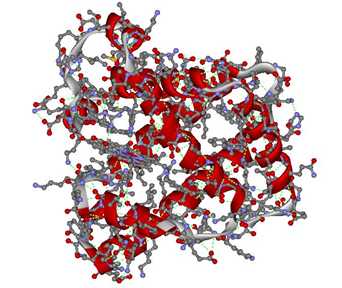
Obr. 6: Počítačový model podjednotky hemoglobinu.
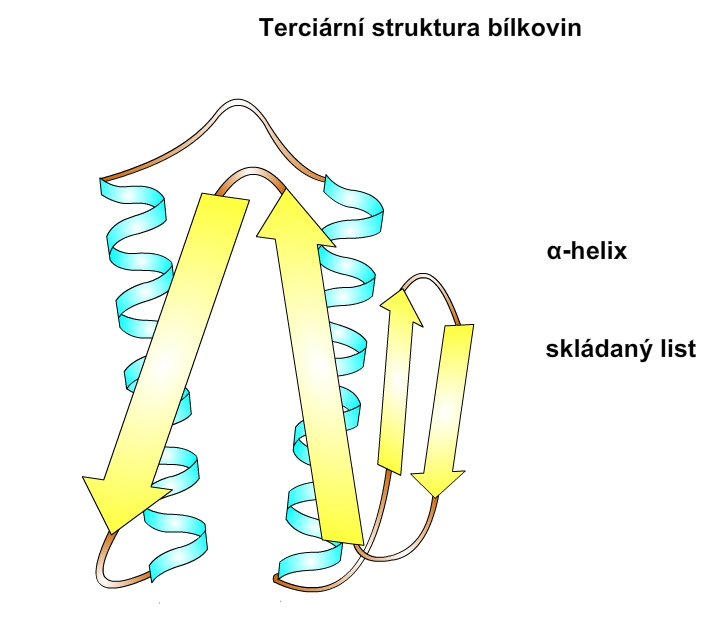
Obr. 7: Znázornění terciární struktury bílkovin (modré šroubovice znázorňují strukturu α-helixu, žluté šipky znázorňují strukturu skládaného listu).
4. Kvartérní struktura
Funkce mnoha bílkovin vychází až ze struktury zkombinované z několika terciárních struktur. Proteiny jsou v tomto případě tvořeny z více než jednoho peptidového řetězce z tzv. podjednotek. Kvartérní struktura udává vzájemnou polohu těchto podjednotek vůči sobě.
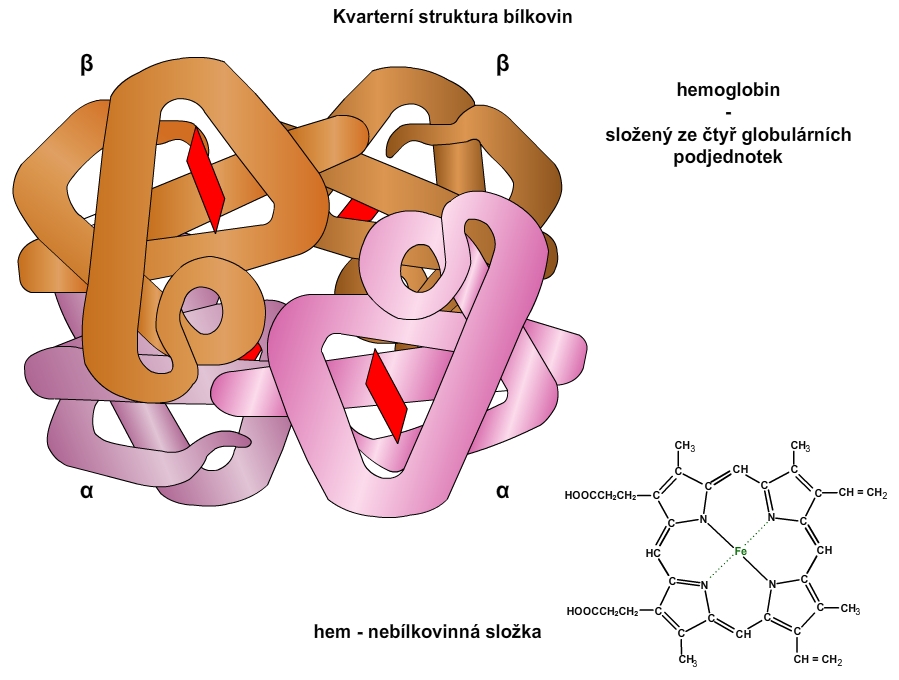
Obr. 8: Kvarterní struktura - pojednotky hemoglobinu.
3. K čemu dochází během denaturace bílkovin?
Působením řady fyzikálních a chemických vlivů se původní prostorové uspořádání bílkovin porušuje. Bílkoviny přecházejí na méně uspořádanou formu. Proteiny během denaturace ztrácejí svou biologickou funkci a mění se řada jejich vlastností, např. denaturace proteinů obvykle zvyšuje jejich stravitelnost. Je to způsobeno tím, že denaturované bílkoviny jsou snadněji přístupné hydrolytickým enzymům.
4. Jaké enzymy se podílejí na trávení bílkovin?
Trávení bílkovin probíhá spontánně v alkalickém i kyselém prostředí. Největší část trávení bílkovin proběhne v žaludku a v tenkém střevě. Trávení bílkovin je založeno na hydrolytickém štěpení peptidové vazby. V lidském těle tento krok katalyzují enzymy zvané proteasy. Proteasy můžeme dále rozdělit na exopeptidasy a endopeptidasy. Exopeptidasy štěpí peptidový řetězec od N-konce (aminopeptidasy) nebo od C-konce (karboxypeptidasy). Endopeptidasy neboli proteinasy štěpí uprostřed peptidového řetězce (např. trypsin, chymotrypsin a pepsin). Dipeptidy a tripeptidy jsou štěpeny enzymy zvanými dipeptidasy a tripeptidasy. V konečném výsledku se do krevního řečiště uvolňují jednotlivé aminokyseliny a kratší peptidové řetězce, které jsou již schopny do tohoto řečiště proniknout. Aminokyseliny mohou být dále používány k biosyntéze dalších produktů.
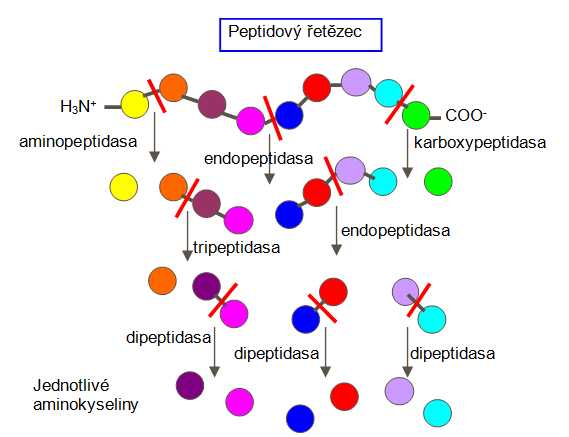
Obr. 9: Schéma trávení bílkovin.